Sērskābe
| Sērskābe | |
|---|---|
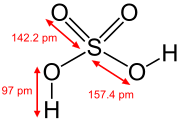 Sērskābes struktūrformula ar starpatomu attālumiem  Sērskābes molekulas modelis  Sērskābes paraugs Latvijas ķīmijas vēstures muzejā | |
| Citi nosaukumi | ūdeņraža tetraoksosulfāts (VI), vitriola eļļa, vitrioleļļa |
| CAS numurs | 7664-93-9 |
| Ķīmiskā formula | H2SO4 |
| Molmasa | 98,08 g/mol |
| Blīvums | 1840 kg/m3 |
| Kušanas temperatūra | 283 K (10 °C) |
| Viršanas temperatūra | 610 K (337 °C) |
| Šķīdība ūdenī | jaucas jebkurās attiecībās |
Sērskābe (H2SO4) tīrā veidā ir eļļains, viegli sasalstošs šķidrums. Ūdens šķīdumos tā ir stipra, neorganiska divvērtīga skābe. Sērskābes sāļus sauc par sulfātiem (dažu metālu sulfātu kristālhidrātus dēvē arī par vitrioliem).
Atrašanās dabā
[labot šo sadaļu | labot pirmkodu]Sērskābe ir nozīmīga skābā lietus sastāvdaļa. Sēra dioksīds dabā lēnām oksidējas par sēra trioksīdu (šis process gan notiek lēnām, taču neatgriezeniski). Šādā veidā no gaisā nonākušā sēra dioksīda veidojas sērskābe.
Iegūšana
[labot šo sadaļu | labot pirmkodu]Sērskābi iegūst, šķīdinot ūdenī sērskābes anhidrīdu SO3. Parasti ķīmiskajā rūpniecībā šķīdināšanai ūdens vietā lieto atšķaidītu sērskābi, lai neveidotos sērskābes migla no ūdens tvaikiem.
Sērskābi parasti ražo, apdedzinot sulfīdus, lielākoties dzelzs persulfīdu (pirītu), ko dēvē par kameru metodi[1]:
- Pirīta FeS2 apdedzināšana
- 4FeS2 + 11O2 → 2Fe2O3 + 8SO2
- SO2 katalītiska reakcija ar O2 vanādija(V) oksīda klātbūtnē:
- 2SO2 + O2 → 2SO3
- Sēra (VI) oksīda reakcija ar ūdeni vai atšķaidītu sērskābes šķīdumu:
- SO3 + H2O → H2SO4
Pirīta vietā ir iespējams lietot arī citus sulfīdus. Vietās, kur lielos daudzumos pieejams sērs vai sērūdeņradis, tos arī var lietot par izejvielām. Pirmās stadijas galaprodukts vienmēr ir sēra dioksīds.
Tālāk sēra dioksīdu oksidē par trioksīdu. Eksistē divas metodes. Izplatītākā ir, lietojot cietu vanādija pentoksīda katalizatoru. Šādā veidā var iegūt tīru un koncentrētu sērskābi.
Pēdējā sērskābes iegūšanas stadija ir sēra trioksīda reakcija ar ūdeni. Lai arī var lietot tīru ūdeni, parasti lieto atšķaidītu sērskābi, jo virs tās ir mazāks ūdens tvaiku spiediens. Sēra trioksīds var reaģēt arī ar ūdens tvaikiem, veidojot sērskābi (smalkas miglas veidā), kuru tālāk ir grūti atfiltrēt. Sēra trioksīdu iespējams arī izšķīdināt koncentrētā sērskābē, iegūstot oleumu.
Nitrozes metode
[labot šo sadaļu | labot pirmkodu]Atšķaidītas sērskābes (līdz 78%) iegūšanai lieto arī homogēno katalīzi ar slāpekļa oksīdu, ko sauc par nitrozes metodi. Ar šo metodi nevar iegūt koncentrētu sērskābi.
- SO2 + H2O + NO2 → H2SO4 + NO
Īpašības
[labot šo sadaļu | labot pirmkodu]Sērskābe reaģē ar lielāko daļu citu skābju sāļu. Sērskābes hidratācija ir eksotermiska, tas nozīmē, ka, šķīdinot sērskābi ūdenī, izdalās siltums.
Koncentrēta sērskābe ir bīstama kodīga viela. Ielejot ūdeni koncentrētā sērskābē, tas var sākt vārīties un izšķaidīt sērskābi visapkārt, tāpēc, atšķaidot sērskābi, tā vienmēr tievā strūkliņā jālej ūdenī, nevis otrādi![2] |

Ja sērskābē izšķīdina sērskābes anhidrīdu, iegūst oleumu (kūpošo sērskābi), to kopā ar slāpekļskābi lieto daudzu organisko vielu nitrēšanai.
Izmantošana
[labot šo sadaļu | labot pirmkodu]Sērskābei ir milzīga nozīme minerālmēslu, piemēram, superfosfāta rūpniecībā.
Koncentrētu sērskābi izmanto kā ūdensatņēmēju vielu, jo tā aktīvi saista ūdens molekulas, veidojot dažāda satura hidrātus. To izmanto celuloīda, mākslīgā zīda, plastmasu, krāsvielu, medikamentu un citu organisko vielu ražošanā. Šīs sērskābes īpašības dēļ to izmanto arī dažādu neorganisko vielu un gāzu žāvēšanai eksikatoros.
Ievērojamus daudzumus šīs skābes patērē naftas produktu attīrīšanā no kaitīgiem piemaisījumiem. Šajos procesos gan veidojas bīstami atkritumi (skābais gudrons). Latvijā, Inčukalnā, ir sērskābā gudrona dīķis.
Atsauces
[labot šo sadaļu | labot pirmkodu]- ↑ Gints Ročāns. Tehnika. Langervaldes iela 1a, Jelgava, LV-3001 : Avots, 2008.gads. 95. lpp. ISBN 978-9984-800-45-5.
- ↑ N.Ahmetovs. Neorganiskā ķīmija, Rīga, "Zvaigzne", 1978, 339. lpp.
Ārējās saites
[labot šo sadaļu | labot pirmkodu] Vikikrātuvē par šo tēmu ir pieejami multivides faili. Skatīt: Sērskābe.
Vikikrātuvē par šo tēmu ir pieejami multivides faili. Skatīt: Sērskābe.
- Encyclopædia Britannica raksts (angliski)
- Krievijas Lielās enciklopēdijas raksts (krieviski)
- Encyclopædia Universalis raksts (franciski)
|
