Brandstofcel

Brandstofcellen zijn elektrochemische toestellen die chemische energie van een doorgaande reactie direct omzetten in elektrische energie. De chemische energie hoeft dus niet meteen omgezet te worden in thermische energie en mechanische energie, maar dat kan dus later, waardoor er minder verliezen optreden en de brandstofcel op een heel efficiënte manier energie omzet. In de cel vindt een redoxreactie plaats. In dit opzicht lijkt een brandstofcel op een batterij of accu; toch is er een belangrijk verschil tussen een accu of batterij en een brandstofcel. In een brandstofcel kunnen namelijk steeds opnieuw reagentia (bijvoorbeeld: waterstof en zuurstof) van buitenaf worden aangevoerd, terwijl de reagentia in een batterij of accu opgeslagen zitten in een gesloten stelsel.
Werking
[bewerken | brontekst bewerken]
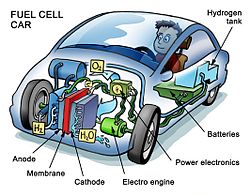
Waterstof en zuurstof worden afzonderlijk van elkaar aan de brandstofcel toegevoerd. De waterstof bij de anode en de zuurstof (oxidator) bij de kathode. In de cel worden deze twee stoffen door een membraan gescheiden. Met behulp van een katalysator wordt de waterstof (H2) aan de anode gesplitst in twee H+-ionen (protonen) en twee elektronen (e−). De elektronen stromen vervolgens via een elektrisch circuit naar de kathode: dit is de elektrische stroom, die gebruikt kan worden om bijvoorbeeld een elektromotor aan te drijven. De protonen stromen door de elektrolyt naar de kathode. De protonen en elektronen komen bij de kathode weer samen en reageren daar met de zuurstof (O2) die bij de kathode wordt ingevoerd. Daarbij ontstaat water (H2O). Hieronder staat een overzicht van de chemische reacties die in een brandstofcel plaatsvinden:
- Anode:
- Kathode:
- Gehele cel: (elektriciteit en warmte)
Een enkele brandstofcel levert in theorie een spanning van ongeveer 1,20 volt, maar in de praktijk ligt die spanning veel lager; tussen de 0,5 en 0,8 volt. Om de spanning te verhogen worden afzonderlijke cellen op elkaar gestapeld en in serie geschakeld. De stapel die zo ontstaat, wordt een brandstofcelstack of stack genoemd.
Rendement
[bewerken | brontekst bewerken]In brandstofcellen zijn hogere rendementen mogelijk dan in gewone verbrandingsmotoren of stoommachines, doordat de energieomzetting niet verloopt volgens de carnotcyclus. In de carnotcyclus wordt de chemische energie namelijk eerst in warmte omgezet en pas daarna in mechanische energie:
- Brandstofcel: chemische energie → elektrische energie
- Carnotcyclus: chemische energie → warmte → mechanische energie (arbeid)
Bij de laatste stap treden als gevolg van de tweede hoofdwet van de thermodynamica noodzakelijkerwijs grote verliezen op, doordat altijd maar een deel van de warmte in arbeid kan worden omgezet. Bij brandstofcellen is dit niet het geval. Toch treden er ook in brandstofcellen omzettingsverliezen op. Een typische brandstofcel van 0,7 volt heeft een rendement van ca. 50%.
Geschiedenis
[bewerken | brontekst bewerken]Het werkingsprincipe van de brandstofcel werd in 1838 ontdekt door de Zwitserse wetenschappelijk onderzoeker Christian Friedrich Schönbein, die zijn bevindingen een jaar later publiceerde in een van de wetenschappelijke tijdschriften uit die tijd. Schönbein schreef dat hij elektriciteit had opgewekt uit de chemische reactie tussen waterstof en zuurstof op plaatjes gemaakt van platina.
Toen de Britse natuurkundige Sir William Robert Grove het artikel van Schönbein las, besefte hij dat de Zwitser een omgekeerde elektrolyse had uitgevoerd. Grove maakte vaker waterstof voor zijn experimenten door elektriciteit door water te voeren, dat daarop gesplitst wordt in waterstofgas en zuurstof. Schönbein had daarentegen waterstof en zuurstof samengevoegd, waarbij elektriciteit vrijkwam. Grove bedacht een manier om die ontdekking op een praktische manier te benutten en kwam in 1843 met de eerste galvanische gasbatterij: een aantal buizen met waterstofgas en zuurstof die samen met enkele andere stoffen ongeveer 36 uur lang stroom produceerden. Deze batterij was de voorloper van wat nu de brandstofcel heet. De batterij produceerde echter te weinig elektriciteit om te kunnen concurreren met de verbrandingsmotor en verdween al snel op de achtergrond.
In 1932 pakte Francis Thomas Bacon (1904-1992) en zijn groep op Cambridge het onderzoek naar de brandstofcel weer op. In 1959 demonstreerden ze hun brandstofcel van vijf kilowatt met een efficiëntieniveau van 60 procent. De cel gebruikte waterstof met een basische elektrolyt (kaliumhydroxide). De elektroden waren gemaakt van poreus nikkel, een goedkope metaalsoort. Rond deze tijd was ook de ruimtewedloop in volle gang en voor het Apolloprogramma was de NASA op zoek naar efficiënte elektriciteitsbronnen met een hoog rendement. De alkalinebrandstofcel van Bacon was uiterst geschikt vanwege zijn hoge rendement en kleine massa en met zuiver water als afvalstof kon hij daarnaast voor drinkwater zorgen. Toch had de alkalinebrandstofcel ook enkele nadelen: de cel was erg duur en ging relatief kort mee.
Verdere technologische ontwikkeling vanaf 1980, zoals het gebruik van Nafion® als elektrolyt en reductie van de hoeveelheid platina, heeft het toepassingsgebied van brandstofcellen vergroot.
Soorten brandstofcellen
[bewerken | brontekst bewerken]
De namen van de verschillende soorten brandstofcellen zijn gebaseerd op het materiaal van de gebruikte elektrolyt. Als men kijkt naar de bedrijfstemperatuur kunnen brandstofcellen in twee groepen worden onderverdeeld:
Lagetemperatuurbrandstofcellen:
- AFC: alkaline fuel cell (alkalische brandstofcel)
- DBFC: direct borohydride fuel cells
- DMFC: direct methanol fuel cell (directmethanolbrandstofcel - genoemd naar de brandstof in plaats van de elektrolyt)
- FAFC: formic acid fuel cell
- PEM FC: proton-exchange membrane fuel cell, of polymer electrolyte fuel cell (vastepolymeerbrandstofcel)
- Omkeerbare brandstofcel
- Redox fuel cell
- Zinc fuel cell
- MFC: microbial fuel cell (biobrandstofcel)
Hogetemperatuurbrandstofcellen:
- PAFC: phosphoric acid fuel cell (fosforzure brandstofcel)
- PCFC: protonic ceramic fuel cell
- MCFC: molten carbonate fuel cell (gesmoltencarbonaatbrandstofcel)
- SOFC: solid oxide fuel cell (vaste-oxidebrandstofcel)
| Type | Elektrolyt | Mobiele ion | Katalysator | Toepassingsvoorbeeld | Bedrijfstemperatuur (°C) |
|---|---|---|---|---|---|
| Alkaline fuel cell (AFC) | Kaliloog (vloeibaar kaliumhydroxide) | Hydroxide-ionen | Platina of kobalt | ruimtevaart, (transport) | < 80 |
| Direct methanol fuel cell (DMFC) | Vast polymeer | Waterstofionen | ? | laptop, mobieltje, draagbare energie, transport. | 90-120 |
| Proton exchange membrane fuel cell (PEMFC) | Vast polymeer | Waterstofionen | Platina-74, Platina/Ruthenium | transport, grootschalige energieopwekking, WKK (warmte-krachtkoppeling), draagbare energie | 50-220 |
| Phosphoric acid fuel cell (PAFC) | Geconcentreerd fosforzuur | Waterstofionen | Platina | grootschalige energieopwekking, WKK | 200 |
| Molten carbonate fuel cell (MCFC) | Mengsel van gesmolten lithium- en kaliumcarbonaten | Carbonaationen | Nikkel of nikkeloxide | grootschalige energieopwekking, WKK | 650 |
| Solid oxide fuel cell (SOFC) | Zirkoniumoxide gestabiliseerd met yttriumoxide | Oxide-ionen | ? | grootschalige energieopwekking, WKK | 800-1000 |
Voortgang
[bewerken | brontekst bewerken]In de hogetemperatuurcellen (MCFC en SOFC) is de verlenging van de levensduur van de celstapelingen tot minstens 90 000 uur (circa 10 jaar) een van de grootste technische uitdagingen.
Anno 2010 is het grootste nadeel van de toepassing van waterstof gelegen in de kosten. Toen NASA voor het eerst een brandstofcel toepaste, kostte een kilowattuur (kWh) ruim 58 euro. In 2000 waren de kosten al teruggelopen tot zo'n 0,10 euro per kWh. Anno 2006 zijn de kosten vooral afhankelijk van de afstand waarover waterstof moet worden aangevoerd. In de regio's Rotterdam en Delfzijl ontstaat waterstof als bijproduct in de procesindustrie. Mede gefinancierd door SenterNovem (uitvoeringsorganisatie van het ministerie van Economische Zaken op het gebied van duurzaamheid en innovatie) heeft de Nederlandse brandstofcelproducent Nedstack samen met AKZO Nobel Chemicals in 2006/2007 in Delfzijl een proef-elektriciteitscentrale gebouwd met een elektrisch vermogen van in eerste instantie 100 kW, met als uiteindelijk doel een PEM-powerplant van 5 MW, waar de brandstofcellen in een duurproef worden getest. De waterstof die als brandstof dient, komt vrij als bijproduct van de elektrolytische bereiding van chloor en de brandstofcellen leveren een deel van de hiervoor benodigde elektriciteit.
Afhankelijk van de brandstof hebben veel brandstofcellen schone afvalproducten, zoals puur water, die het milieu niet belasten. Dit voordeel wordt veelal echter tenietgedaan als de gebruikte brandstoffen uit of met gebruik van bestaande niet-schone energiedragers (aardgas, kolen) moeten worden gewonnen, waarbij wel milieubelasting optreedt. Het zou daarom wenselijk zijn om de brandstof uit een schone bron te betrekken, door bijvoorbeeld met zonne-energie of waterkracht water te splitsen in waterstof en zuurstof. Er is al veel onderzoeks- en ontwikkelingswerk gedaan om op deze manier een schone, zogeheten waterstofeconomie te verwezenlijken; de techniek is zover, de brandstofcellen zijn voldoende ontwikkeld voor bijvoorbeeld toepassing bij Micro-WKK en in auto's, het probleem ligt nu in de distributie van waterstof, zoals de introductie van voldoende tankstations en uitwisselbare (hervulbare) tanks.
Ontwikkelingsbedrijven slagen er rond 2010 in de kostprijs van brandstofcellen elk jaar ongeveer te halveren. Anno 2006 kwamen toepassingsgebieden als stadsbussen, binnenvaartschepen en intern transport in beeld als rendabele toepassing. In 2010 verschenen de eerste brandstofcelsystemen die qua prijs en vermogen de concurrentie aankonden met de hedendaagse verbrandingsmotor. De levensduur is dan nog wel een onzekere factor. Autofabrikant Honda is al sinds 1989 bezig met de ontwikkeling van een auto met brandstofcel. In 1999 begon de eerste tests op de weg om uiteindelijk in 2002 de eerste modellen af te leveren aan onder andere het Japanse kabinet.[1] en Toyota kondigde in 2012 een productiemodel met brandstofcel aan voor 2015.[2] Hyundai heeft de ix35 fuel cell ontwikkeld die inmiddels in beperkte oplage op de Europese markt geïntroduceerd wordt.
Naast op zichzelf werkende brandstofcellen wordt er ook gewerkt aan brandstofcellen die voorgeschakeld worden bij gasturbines[3] en gasmotoren[4].
Ook worden er brandstofcellen ontwikkeld die gekoppeld zijn aan een reformer en zo in staat zijn aardgas, of andere brandstoffen te gebruiken. In een reformer worden de koolwaterstoffen in het aardgas eerst 'gekraakt' tot kleinere waterstofatomen die dan in de brandstofcel verbruikt worden.
Zie ook
[bewerken | brontekst bewerken]Externe links
[bewerken | brontekst bewerken]- Fuel Cell Handbook, Seventh Edition (gedetailleerde informatie over brandstofcellen)
- ↑ http://world.honda.com/FuelCell/
- ↑ http://www.physorg.com/news164958172.html
- ↑ https://web.archive.org/web/20140809234927/https://www.senternovem.nl/projecten/eos/projecten/eos_nieuw_energieonderzoek/waterstof_3/brandstofcellen_onderzoek_en_toepassing/kosteneffectief_voorschakelen_van_een_brandstofcel_(boostercell)_(stork).asp
- ↑ https://web.archive.org/web/20140809214020/http://www.gereports.com/post/92454271755/the-new-power-generation-this-fuel-cell-startup-could



