Bariumsulfaat
| Bariumsulfaat | ||||
|---|---|---|---|---|
| Structuurformule en molecuulmodel | ||||
| ||||
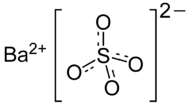
Structuurformule van bariumsulfaat
| ||||

| ||||
Bariumsulfaat-poeder
| ||||
| Algemeen | ||||
| Molecuulformule | BaSO4 | |||
| IUPAC-naam | bariumsulfaat | |||
| Molmassa | 233,3896 g/mol | |||
| SMILES | [O-]S(=O)(=O)[O-].[Ba+2]
| |||
| InChI | 1S/Ba.H2O4S/c;1-5(2,3)4/h;(H2,1,2,3,4)/q+2;/p-2
| |||
| CAS-nummer | 7727-43-7 | |||
| EG-nummer | 231-784-4 | |||
| PubChem | 24414 | |||
| Wikidata | Q309038 | |||
| Beschrijving | Wit kristallijn poeder | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | vast | |||
| Kleur | wit | |||
| Dichtheid | 4,50 g/cm³ | |||
| Smeltpunt | 1580 °C | |||
| Kookpunt | 1600 °C | |||
| Oplosbaarheid in water | (bij 20 °C) 0,002448 g/L | |||
| Goed oplosbaar in | geconcentreerd zwavelzuur | |||
| Onoplosbaar in | water, organische oplosmiddelen | |||
| Brekingsindex | 1,64 | |||
| Evenwichtsconstante(n) | Ks: 1,0842·10−10 (25 °C) | |||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Bariumsulfaat is het bariumzout van zwavelzuur en heeft als brutoformule BaSO4. De stof komt voor als een wit kristallijn poeder, dat vrijwel niet[1] oplosbaar is in water. Het is ook niet oplosbaar in de traditionele organische oplosmiddelen, maar wel in geconcentreerd zwavelzuur. De in oplossing aanwezige verbinding moet dan echter beschreven worden als bariumwaterstofsulfaat, Ba(HSO4)2, omdat zwavelzuur in geconcentreerd zwavelzuur slechts gedeeltelijk ioniseert. Bariumsulfaat komt in de natuur voor onder de vorm van het mineraal bariet, wat tevens een grote bron van barium is. Het wordt geëxtraheerd in een hoogoven, gezien het relatief hoge temperaturen kan weerstaan.
Synthese
[bewerken | brontekst bewerken]Bariumsulfaat kan bereid worden door bariumchloride met zwavelzuur te laten reageren:
Toepassingen
[bewerken | brontekst bewerken]Katalyse-ondersteuning
[bewerken | brontekst bewerken]Bariumsulfaat is een molecuul met een klein contactoppervlak en wordt daarom gebruikt als ondersteuning voor selectieve hydrogenering van functionele groepen die gevoelig zijn voor overreductie. Door het kleine contactoppervlak wordt de contacttijd tussen het substraat en de katalysator sterk verkort.
Contraststof bij röntgenfoto's
[bewerken | brontekst bewerken]
Doordat barium een relatief zwaar en groot atoom is (Z = 56), absorbeert het beter röntgenstraling dan het lichaam. Daarom wordt bariumsulfaat gebruikt als contraststof (bariumpap) bij het maken van röntgenfoto's van wekere delen (organen) van het lichaam. De patiënt neemt dit bariumsulfaat in als een suspensie. Omdat bariumsulfaat geen giftige verbinding is, kan dit geen kwaad in het menselijk lichaam. Bariumsulfaat is niet giftig omdat het - in tegenstelling tot veel andere bariumverbindingen die wel giftig zijn - vrijwel niet oplost in water. Daardoor kan het niet in het metabolisch systeem van het lichaam worden opgenomen.
Pigment
[bewerken | brontekst bewerken]Bariumsulfaat wordt verder nog gebruikt als pigment voor witte verf. Het wordt ook als standaard-wit voor het ijken van de meter bij de kleurmeting gebruikt. Het is een bestanddeel van producten om voegen tussen keramische wandtegels te witten. Samen met zinksulfide wordt het lithopoon genoemd.
Bariumsulfaat wordt in deze context ook wel blanc fixe (Frans voor permanent wit) genoemd.
Andere toepassingen
[bewerken | brontekst bewerken]Bariumsulfaat wordt ook ingezet voor de productie van glas en als vulstof voor de productie van papier en rubber.
Het is goed dispergeerbaar en zorgt ervoor dat de verf of de coating een goede glans behoudt. Het is tevens hitte- en lichtbestendig.
Bariumsulfaat wordt ook gebruikt als toevoeging aan boorvloeistof om het soortelijk gewicht ervan te verhogen.
Het wordt ook gebruikt als geluiddempende laag in "sandwichpanelen", bijvoorbeeld tussen multiplex platen of MDF; met als belangrijke toepassing het omkasten van motoren, scheepsvloeren of als geluiddempende laag in autobussen of treinen.
Polyetheen wordt gemengd met bariumsulfaat voor de productie van afvoerbuizen met sterk verbeterde geluidsdempende eigenschappen.
Eigenschappen en reacties
[bewerken | brontekst bewerken]Bariumsulfaat is een van de meest onoplosbare zouten van barium. Het heeft een oplosbaarheidsproduct (bij 25 °C) Ks van 1,0842 × 10−10. In water kan het sulfaat-ion dus geen hydrolyse ondergaan. Bariumsulfaat lost enkel op in geconcentreerd zwavelzuur.
Bariumsulfaat kan onder hoge temperatuur reageren met koolstof tot bariumsulfide (een zogenaamde carbothermische reductie):
Externe links
[bewerken | brontekst bewerken] bariumsulfaat - International Chemical Safety Card
bariumsulfaat - International Chemical Safety Card- (en) Gegevens van bariumsulfaat in de GESTIS-stoffendatabank van het IFA
- (en) MSDS van bariumsulfaat
- ↑ Voor de chemicus betekent onoplosbaar: de stof is niet aantoonbaar in water aanwezig. Bariumsulfaat is wel aantoonbaar aanwezig, dus niet onoplosbaar. Anderzijds is een oplosbaarheid van nog geen 2,5 mg/l ook niet erg veel. De chemische term is dus: ""slecht oplosbaar"


