Zinksulfaat
| Zinksulfaat | |||||
|---|---|---|---|---|---|
| Structuurformule en molecuulmodel | |||||
Zn2+ + 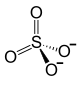
| |||||

| |||||
Zinksulfaat (watervrij)
| |||||
| Algemeen | |||||
| Molecuulformule | ZnSO4 | ||||
| IUPAC-naam | zinksulfaat | ||||
| Andere namen | witte vitriool, zinkvitriool, goslariet | ||||
| Molmassa | 161,43 g/mol | ||||
| SMILES | [O-]S(=O)(=O)[O-].[Zn+2]
| ||||
| CAS-nummer | 7733-02-0 | ||||
| EG-nummer | 231-793-3 | ||||
| PubChem | 24424 | ||||
| Wikidata | Q204954 | ||||
| Waarschuwingen en veiligheidsmaatregelen | |||||
| |||||
| H-zinnen | H302 - H318 - H400 | ||||
| EUH-zinnen | geen | ||||
| P-zinnen | P273 - P280 - P305+P351+P338 - P309+P311 | ||||
| Hygroscopisch? | ja | ||||
| EG-Index-nummer | 030-006-00-9 | ||||
| VN-nummer | 3077 | ||||
| ADR-klasse | Gevarenklasse 9 | ||||
| Fysische eigenschappen | |||||
| Aggregatietoestand | vast | ||||
| Kleur | kleurloos | ||||
| Dichtheid | (watervrij) 3,54 g/cm³ | ||||
| Smeltpunt | (ontleedt) 680 °C | ||||
| Oplosbaarheid in water | (bij 20°C) 220 g/L | ||||
| Goed oplosbaar in | water | ||||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | |||||
| |||||
Zinksulfaat is het zink-zout van zwavelzuur. In watervrije vorm komt het voor als kleurloze hygroscopische kristallen. Deze witte kristallijne stof werd vroeger ook wel "witte vitriool" genoemd en is ook bekend als het mineraal goslariet. De stof is opgenomen in de lijst van essentiële geneesmiddelen van de WHO.
Vorming
[bewerken | brontekst bewerken]Door zink of zinkoxide in verdund zwavelzuur op te lossen, verkrijgt men zinksulfaat:
Men verkrijgt het ook door zink toe te voegen aan een oplossing van het sulfaat van een zwaar metaal:
Zinksulfaat ontstaat ook door de oxidatie van zinksulfide (zinkblende):
Toepassingen
[bewerken | brontekst bewerken]Het heptahydraat wordt o.a. gebruikt bij het bedrukken van katoenweefsels; bij de productie van rayon; in de houtconservering; in diervoeding; in elektroplating; en bij de bereiding van verscheidene zinkverbindingen.
In de geneeskunde werd vroeger "witte vitriool" gebruikt als braakmiddel.
Eigenschappen en gevaren
[bewerken | brontekst bewerken]Zinksulfaat vormt hydraten met water. Bij verhitting komt het kristallisatiewater vrij:
- bij 39°C wordt hexahydraat gevormd;
- bij 70°C wordt monohydraat gevormd;
- bij 240°C wordt watervrij zinksulfaat gevormd.
Bij verder verhitten begint de stof te ontbinden bij ca. 680°C. Boven 930°C blijft zuiver zinkoxide over.
Zinksulfaat is erg irriterend voor de ogen en irriteert ook de luchtwegen en het maag-darmstelsel. Na inslikken kan buikpijn, diarree, misselijkheid of braakneigingen ontstaan.
Zinksulfaat reageert heftig met sterke oxidatiemiddelen. De oplossing in water is een zwak zuur. Zinksulfaat is zeer toxisch voor waterorganismen, en men moet vermijden dat de stof in het milieu terechtkomt.








