Octan ołowiu(IV)
Wygląd
| |||||||||||||||||||||
| |||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||
| Wzór sumaryczny |
C8H12O8Pb | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Inne wzory |
(CH3COO)4Pb, Pb(OAc)4 | ||||||||||||||||||||
| Masa molowa |
443,38 g/mol | ||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||
| Numer CAS | |||||||||||||||||||||
| |||||||||||||||||||||
| |||||||||||||||||||||
| |||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||
Octan ołowiu(IV), (CH
3COO)
4Pb – organiczny związek chemiczny, sól kwasu octowego i ołowiu na stopniu utlenienia IV. Można go otrzymać w reakcji minii ołowiowej z kwasem octowym[1].
Reagent w chemii organicznej
[edytuj | edytuj kod]Octan ołowiu(IV) wykorzystywany jest w chemii organicznej w trzech kierunkach: jako silny utleniacz, jako czynnik acetylujący oraz jako reagent wprowadzający ołów do związków ołowioorganicznych.
Przykłady zastosowań:
- Acetylowanie pozycji benzylowych, allilowych oraz atomów węgla α eterów, np. fotochemiczne przekształcenie 1,4-dioksanu w 1,4-dioksen z wykorzystaniem 2-acetoksy-1,4-dioksanu jako związku pośredniego[2] oraz przekształcenie α-pinenu w werbenon[3].
- Utlenianie hydrazonów do związków diazowych, np. hydrazon heksafluoroacetonu do bis(trifluorometylo)diazometanu[4].
- Tworzenie azyrydyn, np. reakcja ftalimidu ze stilbenem[5].
- Rozerwanie 1,2-dioli do odpowiednich aldehydów lub ketonów (jako alternatywa dla użycia nadjodanów lub ozonolizy, np. utlenianie D-winianu di-n-butylu do glioksylanu n-butylu[6]).
- Przekształcenie alkenów w γ-laktony.
- Utlenianie alkoholi posiadających atom wodoru w pozycji δ w etery cykliczne[7].
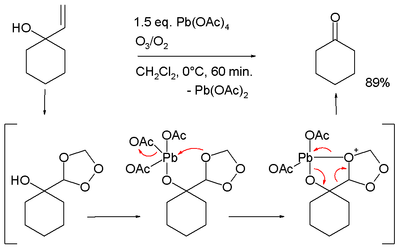
- Oksydatywne rozerwanie niektórych alkoholi allilowych wobec ozonu[8]:
- Przekształcenie acetofenonów w kwasy fenylooctowe[9].
Przypisy
[edytuj | edytuj kod]- ↑ Preparation of Lead(IV)Acetate, Pb(OAc)4. designer-drugs.com. [dostęp 2014-10-30]. [zarchiwizowane z tego adresu (2009-04-12)].
- ↑ Matthew M. Kreilein, James C. Eppich, Leo A. Paquette. 1,4-Dioxene. „Organic Syntheses”. 82, s. 99, 2005. DOI: 10.15227/orgsyn.082.0099.
- ↑ Mark R. Sivik, Kenetha J. Stanton, and Leo A. Paquette. (1R,5R)-(+)-Verbenone of high optical purity. „Organic Syntheses”. 72, s. 57, 1995. DOI: 10.15227/orgsyn.072.0057.
- ↑ W. J. Middleton, D. M. Gale. Bis(trifluoromethyl)diazomethane. „Organic Syntheses”. 50, s. 6, 1970. DOI: 10.15227/orgsyn.050.0006.
- ↑ Robert K. Müller, Renato Joos, Dorothee Felix, Jakob Schreiber, Claude Wintner, A. Eschenmoser. Preparation of n-aminoaziridines: trans-1-amino-2,3-diphenylaziridine, 1-amino-2-phenylaziridine, and 1-amino-2-phenylaziridinium acetate. „Organic Syntheses”. 55, s. 114, 1976. DOI: 10.15227/orgsyn.055.0114.
- ↑ Frank J. Wolf, John Weijlard. n-Butyl glyoxylate. „Organic Syntheses”. 35, s. 18, 1955. DOI: 10.15227/orgsyn.035.0018.
- ↑ Smith, M.B., March, J. March's Advanced Organic Chemistry (Wiley, 2001) (ISBN 0-471-58589-0)
- ↑ Alvarez-Manzaneda, E.J., Chahboun, R., Cano, M.J., Cabrera Torres, E. i inni. O3/Pb(OAc)4: a new and efficient system for the oxidative cleavage of allyl alcohols. „Tetrahedron Letters”. 47 (37), s. 6619-6622, 2006. DOI: 10.1016/j.tetlet.2006.07.020.
- ↑ Myrboh,B., Ila,H., Junjappa,H.. One-Step Synthesis of Methyl Arylacetates from Acetophenones Using Lead(IV) Acetate. „Synthesis”. 1981 (02), s. 126-127, 1981. DOI: 10.1055/s-1981-29358.