Filosofia da Física Quântica 2_a_fundamentos
- 1. Noções básicas de Física Moderna Parte A Fundamentos
- 3. Para interpretar os fenômenos físicos é necessária uma filosofia.
- 4. A filosofia da ciência, a séculos tem uma visão materialista da natureza. (Separação cartesiana entre religião e ciência.)
- 5. Essa visão é dita realismo, e assume que os objetos são reais independentemente das pessoas e da forma com olhamos para os mesmos.
- 6. Então a única realidade é a matéria e nada além dela.
- 8. 1. Objetividade forte “Mente separada da matéria” (separação sujeito-objeto)
- 9. 2. Determinismo Causal “Sabendo as causas sabemos os efeitos”
- 10. 3. Localidade “Nenhuma informação pode propagar-se a uma velocidade maior que a da luz no vácuo”
- 11. 4. Monismo materialista “Tudo é constituído de matéria”
- 12. 5. Princípio do Epifenomenalismo “A mente é um “secreção” do cérebro”
- 13. Objeto Quântico Pode estar em dois lugares ao mesmo tempo Não tem existência no espaço-tempo até ser medido Não segue uma trajetória contínua Sempre fica correlacionado com outro objeto com qual interagiu
- 15. Em 1770 J. Wedgwood (ceramista inglês), descobriu que temperatura, um forno não dependia: nem da forma, material ou combustível do forno, mas apenas da cor da chama.
- 16. A emissão de radiação (luz) é proporcional a cor da luz
- 17. Se uma pedra for colocada ao sol, começará a esquentar, até atingir uma determinada temperatura. Mas em um dado ponto, as mudanças param e ocorre um equilíbrio entre matéria e radiação. Toda radiação que incide agora, é refletida e a temperatura não aumenta mais.
- 18. Ao final do século XIX os físicos estavam empenhados em descobrir uma equação matemática que fornecesse a quantidade de energia emitida por um corpo aquecido. Os valores desses energias eram conhecidos experimentalmente, e produziam o gráfico a seguir.
- 20. Para ajustar uma equação matemática aos dados desse gráfico, usava-se a Física clássica. Este ajuste resultou na equação de Rayleigh-Jeans, que se ajustava bem a cores como o vermelho, mas divergia para cores azul e violeta, o que ficou conhecido como “catástrofe dos ultravioletas”. 4 8)( − = λπλ kTU
- 21. Conclusão A Física do século XIX não reproduzia os resultados experimentais
- 22. Pensamento no final do século XIX Trocas de energia ⇒ contínuas Radiação eletromagnética ⇒ ondas Ondas ⇒ contínuas
- 24. Modelo clássico da radiação Luz como onda Características: •Comprimento de onda λ • Freqüência f •Amplitude A • Velocidade c
- 26. Amplitude - A Classicamente considerava-se Ligada à energia da luz
- 27. Freqüência – f f é o nº de oscilações em um segundo
- 29. Oscilação no tempo Freqüência f nº de oscilações em um segundo
- 30. Velocidade de uma onda eletromagnética (luz) c = 299.792,548 km/s (exato) c ∼ 300.000 km/s c = λf ou ⇒ Maior λ Menor f
- 31. Onda
- 36. Frente de onda plana
- 37. Notação científica Cem = 100 = 102 Mil = 1.000 = 103 Dez mil = 10.000 = 104 Cem mil = 100.000 = 105 Milhão = 1.000.000 = 106 Bilhão = 1.000.000.000 = 109 Trilhão = 1.000.000.000.000 = 1012
- 38. Notação científica 1 décimo = 1/10 = 10-1 1 centésimo = 1/100 = 10-2 1 milésimo = 1/1.000 = 10-3 1 décimo de milésimo = 1/10.000 = 10-4 1 centésimo de milésimo = 1/100.000 = 10-5 1 milionésimo = 1/1.000.000 = 10-6 1 bilionésimo = 1/1.000.000.000 = 10-9 1 trilionésimo = 1/1.000.000.000.000 = 10-12
- 39. Múltiplo de 10 Potência Prefixo Símbolo 1.000.000.000.000 1012 tera T 1.000.000.000 109 giga G 1.000.000 106 mega M 1.000 103 quilo k 100 102 hecto Prefixos de Potências de 10 (Sistema Internacional)
- 40. Múltiplo de 10 Potência Prefixo Símbolo 0,1 10-1 deci d 0,01 10-2 centi c 0,001 10-3 mili m 0,000.001 10-6 micro µ 0,000.000.001 10-9 nano n 0,000.000.000.001 10-12 pico p Prefixos de Potências de 10 (Sistema Internacional)
- 41. Espectro da Radiação Eletromagnética Ondas gravitacionais λ=5·1014 m
- 42. Divisão do espectro eletromagnético entre 3 kHz a 300 GHz
- 44. 400 450 500 550 600 650 até até até até até até 450 500 550 600 650 700 nm nm nm nm nm nm 1 nm = 1 bilionésimo do metro 1 nm = 10-9 m = 1/1.000.000.000 m
- 45. Porque a radiação eletromagnética era considerada uma onda?
- 46. Todas as ondas sofrem: Difração e Interferência
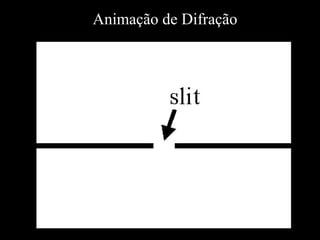
- 47. Difração
- 49. Difração na água
- 53. Interferência
- 57. Interferência na luz – Experiência de Young
- 65. Modelo clássico de absorção da energia (luz)
- 66. Átomo de Thomson (1897) Pudim de passas
- 67. Acreditava-se que os átomos, absorviam energia paulatinamente, ampliando suas oscilações. Modelo clássico de absorção de radiação
- 68. Absorver energia seria com encher um balde com água Modelo clássico de absorção de radiação
- 69. Usando as leis Clássicas, foi obtida a lei de Rayleigh-Jeans 4 8)( − = λπλ kTU
- 70. Paradoxo da quantidade Em 1897 J. J. Thomson enunciava o “paradoxo da quantidade”: Ao dirigir um pulso de raios X a um grupo de moléculas, apenas algumas delas eram ionizadas. O esperado era que todas se ionizassem, já que o Raio X era um pulso ondulatório.
- 71. Paradoxo da quantidade Em 1906 W.H. Bragg também formula o mesmo paradoxo: Como a frente de onda do pulso de Raio X, se estende por uma área grande, então apenas uma pequena parcela da energia, deveria ser absorvida por cada molécula do gás irradiado. Como é possível então, que toda a energia do pulso seja absorvida por uma única molécula do gás.
- 72. Planck e a origem do quantum (1900)
- 73. Formulação do problema da cor da chama em laboratório
- 74. Corpo Negro Corpo que absorve toda a radiação que nele incide e depois reemite toda essa energia.
- 75. O problema da radiação do corpo negro (experimento)
- 76. Planck postulou que interação entre matéria e energia, em vez de ser contínua, era discreta, realizadas por unidades energéticas chamadas quantum, que são a mínima divisão da energia. Não existe meio quantum ou um quantum e meio, existem apenas múltiplos inteiros de um quantum.
- 77. Trocas discretas de energia
- 78. Com essa idéia ele obteve uma equação que se ajustou perfeitamente aos dados já existentes, e ficou conhecida como lei de Planck. Lhe valeu um prêmio Nobel.
- 79. A lei de Planck – trocas discretas h = 6,63⋅10-34 Js Constante de Planck
- 80. A lei de Planck tem sucesso em explicar o espectro da radiação do corpo negro, ajuste perfeito aos dados
- 82. Aplicações do novo conceito O efeito fotoelétrico
- 84. O Efeito Fotoelétrico – problemas 1.O problema da intensidade da luz incidente. 2. O problema da freqüência da luz incidente. 3. O problema do retardo da emissão dos elétrons.
- 85. 1. O problema da intensidade da luz incidente: Acreditava-se que a intensidade era ligada a energia. Experimentalmente: Certas intensidades por mais intensas que fossem, não arrancavam elétrons.
- 86. 2. O problema da freqüência da luz incidente: Acreditava-se que a freqüência não interferia no fenômeno, contudo, havia cores, que não arrancavam elétrons.
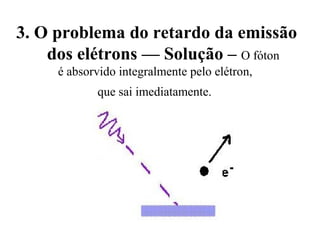
- 87. 3. O problema do retardo da emissão dos elétrons: Acreditava-se que os elétrons deveriam gastar um tempo para absorver a energia necessária e saltar fora do metal
- 89. 1.O problema da intensidade da luz incidente — Solução – Pacote de energia
- 90. 2. O problema da freqüência da luz incidente — Solução – A freqüência está ligada a energia
- 91. 3. O problema do retardo da emissão dos elétrons — Solução – O fóton é absorvido integralmente pelo elétron, que sai imediatamente.
- 92. Efeito fotoelétrico Solução Quantum de luz (característica corpuscular)
- 93. Agora a radiação exibe um comportamento dual ONDA ⇒ difrata e interfere PARTÍCULA ⇒ pacotes de energia
- 94. A freqüência agora está ligada a energia da luz E = hf h = 6,63⋅10-34 Js é a cte de Planck
- 95. A amplitude agora está ligada a intensidade da luz
- 96. Maior freqüência Maior energia
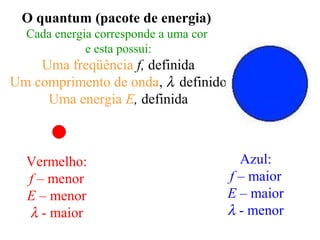
- 97. O quantum (pacote de energia) Cada energia corresponde a uma cor e esta possui: Uma freqüência f, definida Um comprimento de onda, λ definido Uma energia E, definida Vermelho: f – menor E – menor λ - maior Azul: f – maior E – maior λ - menor
- 98. Modelo corpuscular de absorção da radiação Agora a absorção de energia seria como derramar bolas em um balde cada bola ⇒ quantum = pacote de energia
- 101. Arranjo experimental
- 102. Resultado esperado usando o modelo de átomo de Thomson
- 103. Resultados obtidos para os desvios das partículas alfa
- 104. Modelo postulado para a distribuição dos prótons - Núcleo
- 105. Átomos da folha de ouro Ouro - 79 prótons e 118 neutrons ⇒ massa de 197 partículas Partícula alfa - 2 prótons e 2 neutrons ⇒ massa de 4 partículas O núcleo de ouro é ± 50 vezes mais pesado que a partícula alfa
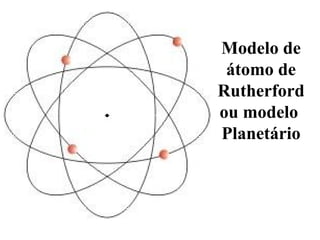
- 106. Modelo de átomo de Rutherford ou modelo Planetário
- 107. Rutherford deduziu que o raio do núcleo era 100.000 vezes menor que o raio do átomo. Se um núcleo tivesse 1cm o elétron ficaria a uma distância de 1km
- 108. E concluiu, que a matéria é, essencialmente, Espaço Vazio
- 109. Problemas com o modelo planetário Colapso ocorreria em 10-9 s
- 110. Átomo de Bohr (1913)
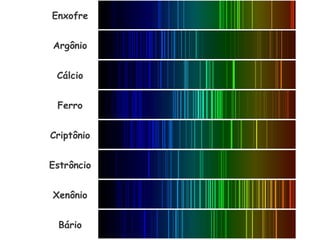
- 111. Espectro de um elemento químico No início do século XX usava muito um resultado experimental, que identificava os elementos químicos pela emissão ou absorção da luz por eles.
- 112. Espectro contínuo
- 117. Átomo de Bohr – órbitas estacionárias
- 118. Átomo de Bohr – Salto quântico
- 119. Salto quântico – níveis de energia
- 120. O modelo de átomo de Bohr, funcionou, perfeitamente quando foi aplicado ao átomo de Hidrogênio. Mas não funcionou, quando foi aplicado ao átomo de Hélio e aos demais.
- 121. Dualidade onda-partícula Agora a energia (luz) exibia um comportamento dual Onda - porque interferia e difratava Partícula - porque produzia o salto quântico (fóton)
- 123. Se a onda se comporta como partícula será que a partícula se comporta como onda?
- 124. Comprimento de onda de de Broglie: λ= h/mv Para a luz verde o comprimento de onda de é: λ = 5⋅10-7 m Para uma pessoa com 53 kg andando a 5 km/h, o comprimento de onda é: λ = 2,5⋅10-37 m
- 125. Experimento de Davidson e Germer Difração de elétrons (1927)
- 126. Agora a matéria também exibe um comportamento dual ONDA ⇒ difrata e interfere PARTÍCULA ⇒ localizada no espaço Onda (Radiação) ⇒ Partícula Partícula (Matéria) ⇒ Onda
- 127. Em 1996, os físicos americanos David Wineland e Chris Monroe, do Instituto Nacional de Padrões e Tecnologia, em Boulder, Colorado (EUA), conseguiram fazer um átomo permanecer em dois pontos diferentes do espaço no mesmo e exato instante. Dez anos antes, só se conseguia a proeza com partículas subatômicas. Wineland e Monroe fizeram isso com um átomo 100.000 vezes maior do que qualquer subpartícula, dilatando a fronteira entre fenômenos microscópicos e macroscópicos. O próximo passo é passar do átomo para a molécula. Depois, pode ser a vez dos animais. Quem sabe até racionais.
- 128. Foi então que surgiu uma formulação que conseguiu o sucesso. A formulação Quântica.
- 129. Formulação da Física Quântica Equação de Schrödinger (1926) Mecânica Matricial de Heisenberg (1927)
- 130. Equação de Schrödinger Função de onda (onda de probabilidade)
- 131. Átomo de como distribuição de probabilidades
- 133. Elétron como onda no átomo
- 135. Observar elétrons é como observar vaga-lumes numa noite
- 136. Princípio da indeterminação de Heisenberg ≤∆∆ px ≤∆∆ tE
- 138. Efeito Túnel
- 140. Análogo clássico do efeito túnelReflexão Total Tunelamento
- 141. Princípio da complementaridade ou medimos onda ou medimos partícula
- 142. Princípio da correspondência A Física Clássica é válida, sempre que as dimensões dos corpos tendam ao nível macroscópico
- 143. Interpretação de Copenhagem Partícula ou onda? Não há sentido perguntar antes de uma medida
- 145. 1. Objetividade forte “Mente separada da matéria” (separação sujeito-objeto) Ao escolhermos o tipo de dispositivo que vai medir o objeto quântico (OQ) (fóton/elétron), decidimos como ele vai se comportar onda/partícula. Portanto, somos nós que determinamos como esse OQ vai se manifestar. Então, não pode haver separação sujeito-objeto.
- 146. 2. Determinismo Causal “Sabendo as causas sabemos os efeitos” O comportamento dos OQs é probabilístico e probabilidade gera indeterminação. Não pode haver determinismo.
- 147. 3. Localidade “Nenhuma informação pode propagar-se a uma velocidade maior que a da luz no vácuo” Os OQs também são ondas, e estas não são localizadas no espaço. Verifica-se que podem existir interações não locais (veremos na parte B )
- 148. 4. Monismo Materialista e 5. Princípio do Epifenomenalismo “Tudo é constituído de matéria” “A mente é um “secreção” do cérebro” Se o cérebro é constituído de matéria, e gera a mente, como a mente pode decidir, como o cérebro se comportará, se é este que a gera? Se somos nós que decidimos, o tipo de experimento que será montado, definimos assim, como o OQ irá se comportar: Se montarmos um exp. de Young o fóton irá se comportar como onda Se montarmos um exp. de efeito fotoelétrico o fóton irá se comportar como partícula
- 149. Final da 2ª parte A