Quimica
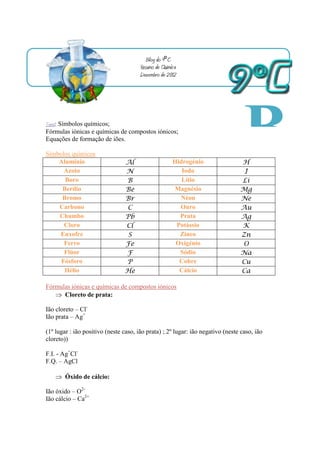
- 1. Blog do 9ºC Resumo de Química Dezembro de 2012 Tema: Símbolos químicos; Fórmulas iónicas e químicas de compostos iónicos; Equações de formação de iões. Símbolos químicos Alumínio Azoto Al N Hidrogénio Iodo H I B Boro B Lítio Li Berílio Bromo Carbono Chumbo Cloro Enxofre Ferro Be Br C Pb Cl S Fe Magnésio Néon Ouro Prata Potássio Zinco Oxigénio Mg Ne Au Ag K Zn O lo Flúor F Sódio Na g Fósforo P Cobre Cu Hélio He Cálcio Ca Fórmulas iónicas e químicas de compostos iónicos Cloreto de prata: Ião cloreto – Cl- Ião prata – Ag+ (1º lugar : ião positivo (neste caso, ião prata) ; 2º lugar: ião negativo (neste caso, ião cloreto)) F.I. - Ag+Cl- F.Q. – AgCl Óxido de cálcio: Ião óxido – O2- Ião cálcio – Ca2+
- 2. F.I. – Ca2+O2- F.Q. – CaO Óxido de sódio: Ião óxido – O2- Ião sódio – Na+ F.I. – (Na+)2O2- F.Q. – Na2O Hidróxido de cálcio: Ião hidróxido – HO- Ião cálcio – Ca2+ F.I. – Ca2+(OH-)2 F.Q. – Ca(OH)2 Quando se passa de F.I. para F.Q. se se tiver colocado parêntesis nos... - iões monoatómicos -> tira-se os parêntesis - iões poliatómicos -> não se tira os parêntesis Equações de formação de iões Fe Fe3++3é O+2é O2- F+1é F-