Resumo Físico-Química
- 1. Blog Preparações e Ficha de Preparação para Revisões 8ºC o Teste de Físico-química Transformações Físicas e Químicas: FÍSICAS – transformações nas quais os materiais só alteram algumas das suas prioridades. Não se formam novas substâncias. QUÍMICAS – transformações em que se deteta a formação de novas substâncias podendo implicar libertação de um gás, mudança de cor, cheiro caraterístico , uma chama ou um ruído e variação de temperatura. Transformações químicas Uma substância pode decompor-se dando origem a outras por ação: Mecânica (Fricção) – Acender um fósforo. Da luz (Fotólise) – Fotossíntese. Do Calor (Termólise) – Decomposição de Dicromato de Amónio. Da Corrente Elétrica (Eletrólise) – Decomposição da água 1. Considera as situações que se seguem e refere se correspondem a Transformações Físicas ou Químicas. A – Fritar um ovo. ______________ B – “Derreter” chocolate em banho-maria. _______________ C – Escurecimento da pele no verão. _____________ D – Enferrujamento dos portões. ______________ E – “Desaparecimento” da acetona do frasco, quando aberto. _________ F – Queimar madeira. ___________
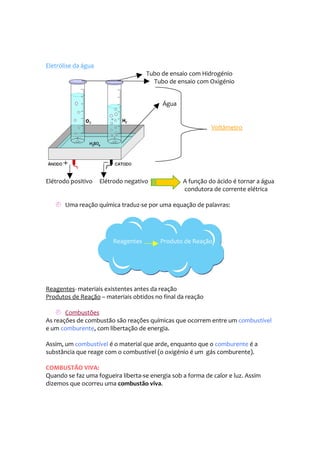
- 2. Eletrólise da água Tubo de ensaio com Hidrogénio Tubo de ensaio com Oxigénio Água Voltâmetro Elétrodo positivo Elétrodo negativo A função do ácido é tornar a água condutora de corrente elétrica Uma reação química traduz-se por uma equação de palavras: Reagentes Produto de Reação Reagentes- materiais existentes antes da reação Produtos de Reação – materiais obtidos no final da reação Combustões As reações de combustão são reações químicas que ocorrem entre um combustível e um comburente, com libertação de energia. Assim, um combustível é o material que arde, enquanto que o comburente é a substância que reage com o combustível (o oxigénio é um gás comburente). COMBUSTÃO VIVA: Quando se faz uma fogueira liberta-se energia sob a forma de calor e luz. Assim dizemos que ocorreu uma combustão viva.
- 3. COMBUSTÃO LENTA: No dia – a - dia humano ocorrem muitas outras reações como o oxigénio no ar, mas sem chama. É o caso, por exemplo do ferro, que quando exposto ao ar húmido oxida, ou seja, enferruja. O enferrujamento do ferro conduz à sua corrosão/degradação. Para evitar a corrosão, os metais são pintados, envernizados ou revestidos por outros metais ou por outro tipo de materiais de proteção. Mas nem todos os metais sofrem corrosões quando oxidados; por exemplo, o zinco, o cobre e o alumínio não sofrem estas corrosões. Isto porque, nestes metais, a película fina do óxido que se forma protege-os da ação do ar, pois estes óxidos não são permeáveis ao oxigénio. Assim dizemos que é uma combustão lenta, pois não forma chama. Soluções ácidas/neutras/básicas As soluções ácidas são caraterizadas por: Terem sabor azedo; Avermelharem a tintura azul de tornesol; Reagirem com alguns metais, corroendo-os; Reagirem com o calcário, libertando dióxido de carbono; Conduzirem a corrente elétrica. As soluções básicas são caraterizadas por: Serem escorregadias ao tacto; Tornarem carmim a solução alcoólica de fenolftaleína; Conduzirem a corrente elétrica. EXEMPLOS: Soluções ácidas – sumos, vinagre, leite, frutos, etc. Soluções neutras – água destilada, etc. Soluções básicas – detergente, lixívia, fermento, etc. INDICADORES DE ÁCIDO BASE São substâncias que adquirem cor diferente na presença de soluções ácidas, neutras ou básicas: o Tintura de Tornesol: torna-se vermelha na presença de soluções ácidas; o Fenolftaleína: torna-se azul na presença de soluções básicas (indicador incolor); o Indicador Universal: indicador mais rigoroso que nos dá o grau de acidez ou de basicidade de uma solução.
- 4. Reações de Precipitação: As reacções de precipitação são reações em que se formam sais pouco solúveis em água. Estes sais pouco solúveis chamam-se precipitados. LEI DE LAVOISIER « Na Natureza nada se perde, nada se cria, tudo se transforma» - Antoine Lavoisier A Lei de Lavoisier diz que: A massa dos reagentes é igual à massa dos produtos de reação. FATORES QUE INFLUENCIAM A VELOCIDADE DE UMA REAÇÃO QUÍMICA Natureza dos reagentes; Concentração dos reagentes (quanto mais concentrados maior a velocidade); Temperatura (quanto maior a temperatura, maior a velocidade); Luz (há reações que quando expostas à luz, aumentam a velocidade); Estado de divisão (quanto mais dividido estiver, maior é a velocidade); Catalisadores/Inibidores (aceleram/diminuem a velocidade respetivamente). TEORIA CORPUSCULAR DA MATÉRIA A matéria é constituída por pequeníssimos corpúsculos; Os corpúsculos estão sempre em constante movimento; Entre os corpúsculos existem espaços vazios.
- 5. ÁTOMOS E MOLÉCULAS O átomo é uma partícula muito pequena de matéria (visível apenas com microscópios eletrónicos especiais) que contém cargas elétricas negativas e positivas, mas no qual essas cargas se anulam. Assim, a carga total de um átomo é zero. Existem substâncias formadas por átomos sozinhos (Árgon e Hélio), estes átomos estão sozinhos porque são eletricamente estáveis deste modo e não precisam de se ligar a outros. Uma molécula é o conjunto de dois ou mais átomos que não são estáveis sozinhos. A carga total de uma molécula também é neutra.