Pentóxido de dinitrogênio
| Pentóxido de dinitrogênio Alerta sobre risco à saúde | |
|---|---|
| |

| |
| Outros nomes | Óxido de nitrogénio (V) Anidrido nítrico dnpo |
| Identificadores | |
| Número CAS | |
| PubChem | |
| Propriedades | |
| Fórmula química | N2O5 |
| Massa molar | 107.98 g mol-1 |
| Aparência | sólido branco |
| Densidade | 1.642 g/cm3 (18 °C), sólido |
| Ponto de fusão |
41 °C (sob pressão |
| Ponto de ebulição |
47 °C subl. |
| Solubilidade em água | reage com a água, formando ácido nítrico |
| Solubilidade | solúvel em clorofórmio |
| Estrutura | |
| Geometria de coordenação |
linear entre o N2O e planar entre o NO3 |
| Termoquímica | |
| Entalpia padrão de formação ΔfH |
-43.1 kJ/mol (s) +11.3 kJ/mol (g) |
| Entropia molar padrão S |
178.2 J K-1 mol-1 (s) 355.6 J K-1 mol-1 (g) |
| Riscos associados | |
| Principais riscos associados |
Oxidante forte, forma um ácido forte quando em contacto com água |
| NFPA 704 | |
| Compostos relacionados | |
| Outros catiões/cátions | Pentóxido de fósforo Dióxido de carbono |
| Óxidos de nitrogênio relacionados | Óxido nitroso Óxido nítrico Trióxido de dinitrogênio Dióxido de nitrogênio Tetróxido de dinitrogênio |
| Compostos relacionados | Ácido nítrico |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
Pentóxido de dinitrogênio (fórmula N2O5) é um composto químico, sólido, branco, também conhecido por anidrido nítrico e citado como pentóxido de nitrogênio. O pentóxido de dinitrogênio encontra-se em estado sólido à temperatura ambiente (ao contrário dos outros óxidos de nitrogênio) e tem o ponto de fusão aos 30 °C.
N2O5 é um dos óxidos binários do nitrogênio, uma família de compostos que contém somente nitrogênio e oxigênio.
É estável num local sombrio e a temperaturas inferiores a 8 °C.
De todos os óxidos de nitrogênio é o que apresenta maior força de ionização, o que lhe confere grande capacidade de combustão. Este óxido tem um número de oxidação de +5.
É altamente reactivo, instável, e ao misturar-se com água produz ácido nítrico; é utilizado na preparação de explosivos. É um oxidante potencialmente perigoso que somente é usado como um reagente quando dissolvido em clorofórmio para nitrações mas tem largamente sido substituído pelo NO2BF4 (tetrafluoroborato de nitrônio).
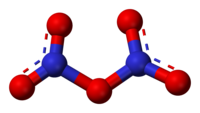
N2O5 é um raro exemplo de um composto que adota duas estruturas dependendo das condições: mais comumente é um sal, mas sob outras condições é uma molécula apolar:
- N2O5 ⇌ [NO2+][NO3−]
Síntese e propriedades
[editar | editar código-fonte]N2O5 foi primeiramente descrito por Deville em 1840, que o preparou por tratar AgNO3 com Cl2.[1] Uma síntese laboratorial recomendada implica desidratação de ácido nítrico (HNO3) com óxido de fósforo (V):[2]
- P4O10 + 12 HNO3 → 4 H3PO4 + 6 N2O5
No processo reverso, N2O5 reage com água (hidrolisando-se) para produzir ácido nítrico. Então, o pentóxido de nitrogênio é o anidrido do ácido nítrico:
- N2O5 + H2O → 2 HNO3
N2O5 existe como cristais incolores que sublimam levemente sob temperatura ambiente. O sal eventualmente decompõe-se à temperatura em NO2 e O2.[3]
Estrutura
[editar | editar código-fonte]
N2O5 sólido é um sal, consistindo se ânions e cátions separados. O cátion é o íon nitrônio linear NO2+ e o ânion é o íon nitrato planar NO3−. Então, o sólido deveria ser chamado nitrato de nitrônio. Mas os nitrogênios centrais tem estado de oxidação +5.
A molécula intacta O2N–O–NO2 existe na fase gás (obtida por sublimação de N2O5) e quando o sólido é extraído em solventes apolares tais como CCl4. Na fase gás, o ângulo O–N–O é 133° e o ângulo N–O–N é 114°. Quando N2O5 gasoso é resfriado rapidamente ("extinto"), pode-se obter a forma molecular metaestável, a qual exotermicamente converte-se à forma iônica acima de −70 °C.[2]
Reações e aplicações
[editar | editar código-fonte]Pentóxido de dinitrogênio, por exemplo como uma solução em clorofórmio, tem sido usado como um reagente para introduzir a funcionalidade NO2. Esta reação de nitração é representada como segue:
- N2O5 + Ar–H → HNO3 + Ar–NO2
onde Ar representa uma estrutura areno.
N2O5 é de interesse para a preparação de explosivos.[4]
NO2BF4
[editar | editar código-fonte]A substituição da porção NO3− de N2O5 com BF4− resulta em NO2BF4 (CAS#13826-86-3). Este sal mantém a alta reatividade do NO2+, mas é termicamente estável, decompondo-se a aproximadamente 180°C (em NO2F e BF3). NO2BF4 tem sido usado para nitrar uma variedade de compostos orgânicos, especialmente arenos e heterocíclicos. De maneira interessante, a reatividade do NO2+ pode ser reforçada com ácidos fortes que geram o "super-eletrófilo" HNO22+.
Considerações de segurança
[editar | editar código-fonte]N2O5 é um oxidante enérgico que forma misturas explosivas com compostos orgãnicos e sais de amônio. A decomposição de pentóxido de dinitrogênio produz o gás altamente tóxico dióxido de nitrogênio.
Referências
[editar | editar código-fonte]- ↑ M.H. Deville, Campt. Rend. Acad. Sci. Paris 28 (1849)
- ↑ a b Holleman, A. F.; Wiberg, E. (2001), Inorganic Chemistry, San Diego: Academic Press, ISBN 0-12-352651-5
- ↑ «Nitrogen(V) Oxide», Inorg. Synth., 3: 78–81, 1950
- ↑ Talawar, M. B.; Sivabalan, R.; Polke, B. G.; Nair, U. R.; Gore, G. M.; Asthana, S. N. "Establishment of Process Technology for the Manufacture of Dinitrogen Pentoxide and its Utility for the Synthesis of Most Powerful Explosive of Today--CL-20", Journal of Hazardous Materials, 2005, volume 124, pages 153-64.

