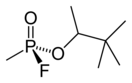
Зома́н — фосфорорганическое вещество, бесцветная жидкость, имеющая, по разным данным, запах яблок, камфоры или слабый запах скошенного сена. Относится к боевым отравляющим веществам, с ярко выраженным нервно-паралитическим воздействием. По многим свойствам очень похож на зарин, однако токсичнее его более чем в 2,5 раза. Стойкость зомана несколько выше, чем у зарина. Используется смесь четырёх стереоизомеров без разделения.
| Зоман | |||
|---|---|---|---|
| |||
| Общие | |||
| Систематическое наименование |
2-(Фторметилфосфорил)окси-3,3-диметилбутан | ||
| Сокращения | GD, EA 1210, PFMP | ||
| Традиционные названия | Пинаколиновый эфир фторангидрида метилфосфоновой кислоты | ||
| Хим. формула | C7H16FO2 | ||
| Физические свойства | |||
| Состояние | жидкость | ||
| Молярная масса | 182,17 г/моль | ||
| Плотность | 1,0131[1] | ||
| Термические свойства | |||
| Температура | |||
| • плавления | −80 °C | ||
| • кипения | около 190 °C (с разложением)[1] °C | ||
| • разложения | более 150[1] | ||
| Давление пара | 0,3 мм рт. ст. при +20 °C | ||
| Химические свойства | |||
| Растворимость | |||
| • в воде | плохая | ||
| • в спирты, кетоны, сложные эфиры, алкилгалогениды | хорошая | ||
| Оптические свойства | |||
| Показатель преломления | 1,4080 (D-линия натрия)[1] | ||
| Классификация | |||
| Рег. номер CAS | 96-64-0 | ||
| PubChem | 7305 | ||
| SMILES | |||
| InChI | |||
| ChEBI | 9195 | ||
| ChemSpider | 7032 | ||
| Безопасность | |||
| Предельная концентрация | 5·10-13 кг/м3 (в воздухе) | ||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Синтез и свойства
правитьЗоман является аналогом зарина, оба этих соединения являются сложными эфирами метилфторфосфоновой кислоты: зоман — пинаколиловым эфиром, зарин — изопропиловым. Химические свойства зомана аналогичны свойствам зарина, однако его реакционная способность по отношению к нуклеофилам понижена из-за стерических затруднений, создаваемых более объёмистым пинаколильным заместителем.
Зоман плохо растворим в воде (1,5 % при +25 °C), легко растворяется в спиртах и кетонах, а также в сложных эфирах и алкилгалогенидах. В кислых, нейтральных и слабощелочных средах гидролизуется медленно, наиболее медленный гидролиз наблюдается при pH = 4. Время гидролиза на 50 % при +30 °С и pH 2, 4 и 7 составляет соответственно 6.4, 250 и 41 час. При pH > 10 гидролизуется быстро; в 5 % NaOH реакция завершается через 5 минут, легко реагирует с растворами аммиака и аминов. При температуре >150 °C полностью разлагается, деструкция ускоряется в присутствии веществ кислотного характера. Температура кипения при атмосферном давлении около 190 °C, при давлении 0,1 мм рт. ст. 42 °C. Плотность 1,0131 г/см3 (при +20 °C). Коэффициент преломления 1,4080 (для жёлтого дублета натрия)[1].
Синтез зомана аналогичен синтезу зарина — его проводят этерификацией пинаколилового спирта (3,3-диметилбутан-2-ола) смесью дихлор- и дифторангидридов метилфосфоновой кислоты:
- CH3POCl2 + CH3POF2 + 2CH3CH(OH)C(CH3)3 2CH3P(=O)(F)OCH(CH3)C(CH3)3
Токсичность
правитьЧрезвычайно токсичное вещество, преимущественно нейротропного воздействия (поражает нервную систему). Зоман является ингибитором холинэстеразы. Первые признаки поражения наблюдаются при концентрациях около 0,0005 мг/л через минуту (сужение зрачков глаз, затруднение дыхания). Среднесмертельная концентрация при действии через органы дыхания 0,03 мг·мин/л. Смертельная концентрация при резорбции через кожу — 2 мг/кг. Защита от зомана — противогаз и средства защиты кожи, а также антидоты. Впервые синтезирован в Германии Рихардом Куном в 1944 году для использования в качестве боевого отравляющего вещества.
Как антидоты можно применять атропин или пралидоксим, для снятия побочных симптомов (тревоги, эмоционального напряжения) можно использовать диазепам.
-
Синтез агента GD
-
Метаболизм зомана.
Примечания
править- ↑ 1 2 3 4 5 Емельянов В. И. Зоман // Химическая энциклопедия : в 5 т. / Гл. ред. И. Л. Кнунянц. — М.: Советская энциклопедия, 1990. — Т. 2: Даффа — Меди. — С. 175. — 671 с. — 100 000 экз. — ISBN 5-85270-035-5.
Это заготовка статьи об органическом веществе. Помогите Википедии, дополнив её. |