Вещество (химия)
Вещества, изучаемые химией (англ. chemical substances) — вещества, состоящие из атомов; вещества, в которых выделение атомов невозможно или теряет физический смысл (например, плазма или звёздное вещество), к предмету рассмотрения химией не относят[1]. Состоящее из атомов вещество — основной объект изучения химии. Вещества в химии принято разделять на индивидуальные вещества (простые и сложные), организованные в атомы, молекулы, ионы и радикалы, и их смеси[2]. Простое вещество образовано атомами одного химического элемента и является формой его существования в свободном состоянии (элементарная сера, железо, озон, алмаз, азот, …). Сложные вещества образованы разными элементами и могут иметь состав постоянный (стехиометрические соединения, или дальтониды) или меняющийся в некоторых пределах (нестехиометрические соединения, или бертоллиды). Вещества превращаются друг в друга в процессе химических реакций, однако таким образом одно простое вещество невозможно превратить в другое, образованное из атомов иного элемента.

Наименование
[править | править код]Каждое вещество имеет одно или несколько названий, в соответствии с правилами номенклатуры ИЮПАК. Есть и альтернативная система, используемая Химической реферативной службой (CAS).
Классификация веществ
[править | править код]
Химическая классификация
[править | править код]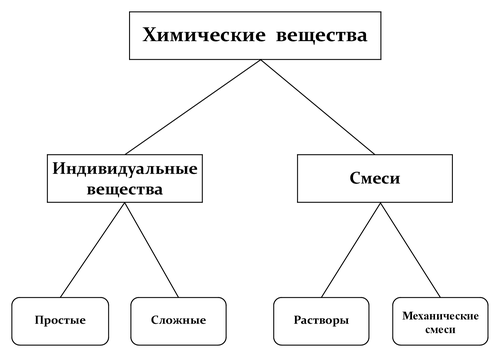
Традиционная эмпирическая классификация веществ в химии основана на их делимости на составные части[3][4][5][6] и не использует представления атомно-молекулярной теории.
По состоянию на 2012 год существует 118 известных элементов, около 80 из которых являются стабильными, то есть они не изменяются в результате радиоактивного распада в другие элементы. Большинство элементов классифицируются как металлы. Это элементы с характерным блеском, такие как железо, медь и золото. Металлы обычно проводят электричество и тепло, они податливы и пластичны[7]. Около десятка элементов, таких как углерод, азот и кислород, классифицируются как неметаллы. Неметаллы не обладают металлическими свойствами, описанными выше, они также обладают высокой электроотрицательностью и склонностью к образованию отрицательных ионов. Некоторые элементы, такие как кремний, иногда напоминают металлы, а иногда напоминают неметаллы и известны как полуметаллы.
Индивидуальные вещества и смеси
[править | править код]В отечественной литературе по химии принято делить вещества на индивидуальные (чистые) вещества (простые и сложные) и их смеси[8][9][10][11]. На сегодняшний день стандартизированная дефиниция индивидуального вещества отсутствует[11]. Согласно одному из вариантов индивидуальным называют вещество, которое нельзя разделить на более простые составные части только физическими методами[10] (речь идёт о принципиальной осуществимости такого разделения, а не о практическом реализации теоретически возможного метода). Второй вариант дефиниции основан на связи постоянства свойств вещества с его чистотой[12]. Для установления свойств вещества оно должно быть возможно более чистым, так как примеси изменяют числовые значения характеризующих вещество физических параметров, в частности, температур фазовых переходов. Вещество с минимально достижимым содержанием примесей (в идеале — нулевым) называют индивидуальным веществом[13]. В физической химии используют не термин «индивидуальное вещество», а его ИЮПАКовский синоним — составляющее вещество[14], понимая под ним любое вещество, которое может быть выделено из системы и существовать вне её[15][16][17][18] (иногда говорят не о составляющих веществах и независимых составляющих веществах — компонентах, — а о компонентах и независимых компонентах[19][20]). Отказ от использования терминов «чистое вещество» и «индивидуальное вещество» исключает произвол, связанный с привязкой этих понятий к степени чистоты вещества и требованиям постоянства его состава и свойств.
Индивидуальные вещества делятся на неорганические и органические вещества:
Примечания
[править | править код]- ↑ Зоркий П. М. Критический взгляд на основные понятия химии. Дата обращения: 18 декабря 2015. Архивировано 4 марта 2016 года.
- ↑ Вещество // Химическая энциклопедия, 1988, т. 1, с. 361. Дата обращения: 4 мая 2020. Архивировано 18 мая 2017 года.
- ↑ Ходаков, 1954, с. 15.
- ↑ Ходаков, 1975, с. 26.
- ↑ Рудзитис, Фельдман, 1985, с. 7—15.
- ↑ Рудзитис, Фельдман, 2011, с. 7—18.
- ↑ Hill, J. W.; Petrucci, R. H.; McCreary, T. W.; Perry, S. S. General Chemistry, 4th ed., pp 45–46, Pearson Prentice Hall, Upper Saddle River, New Jersey, 2005.
- ↑ Глинка, 2014, с. 15—16.
- ↑ Рудзитис, Фельдман, 2011, с. 7—8.
- ↑ 1 2 Вольхин, 2002, с. 23.
- ↑ 1 2 Жуков С. Т. Основные представления и понятия химии, 2002. Дата обращения: 4 декабря 2015. Архивировано 3 марта 2016 года.
- ↑ Ходаков, 1975, с. 30.
- ↑ Глинка, 2014, с. 15.
- ↑ constituent // IUPAC Gold Book Архивная копия от 10 июля 2015 на Wayback Machine.
- ↑ Коган и др., 2013, с. 11.
- ↑ Мечковский, Блохин, 2010, с. 127.
- ↑ Еремин и др., 2005, с. 12.
- ↑ Герасимов, 1970, с. 331.
- ↑ Сивухин, 2005, с. 489.
- ↑ Путилов, 1971, с. 230.
Литература
[править | править код]- Вольхин В. В. Общая химия. Основы химии. — Пермь: Перм. гос. тех. ун-т, 2002. — 512 с. — ISBN 5-88151-309-6.
- Герасимов Я. И., Древинг В. П., Еремин Е. Н. и др. Курс физической химии / Под общ. ред. Я. И. Герасимова. — 2-е изд. — М.: Химия, 1970. — Т. I. — 592 с.
- Глинка Н. Л. Общая химия. Учебник для бакалавров / Под ред. В. А. Попкова и А. В. Бабкова. — 19-е изд., перераб. и доп. — М.: Юрайт, 2014. — 910 с. — (Бакалавр. Базовый курс). — ISBN 978-5-9916-3158-7.
- Еремин В. В., Каргов С. И., Успенская И. А. и др. Основы физической химии. Теория и задачи. — М.: Экзамен, 2005. — 481 с. — (Классический университетский учебник). — ISBN 5-472-00834-4.
- Коган В. Е., Литвинова Т. Е., Чиркст Д. Э., Шахпаронова Т. С. Физическая химия / Науч. ред. проф. Д. Э. Чиркст. — СПб.: Национальный минерально-сырьевой ун-т «Горный», 2013. — 450 с.
- Мечковский Л. А., Блохин А. В. Химическая термодинамика. Курс лекций. В двух частях. Часть 1. Феноменологическая термодинамика. Основные понятия, фазовые равновесия. — Минск: БГУ, 2010. — 141 с.
- Путилов К. А. Термодинамика / Отв. ред. М. Х. Карапетьянц. — М.: Наука, 1971. — 376 с.
- Рудзитис Г. Е., Фельдман Ф. Г. Химия. Учебное пособие для 7—11 классов вечерней (сменной) средней общеобразовательной школы. В 2-х частях. Часть I. — М.: Просвещение, 1985. — 192 с.
- Рудзитис Г. Е., Фельдман Ф. Г. Химия. Неорганическая химия. 8 класс. — 15-е изд. — М.: Просвещение, 2011. — 176 с. — ISBN 978-5-09-025532-5.
- Сивухин Д. В. Общий курс физики. Т. II. Термодинамика и молекулярная физика. — 5-е изд., испр. — М.: ФИЗМАТЛИТ, 2005. — 544 с. — ISBN 5-9221-0601-5.
- Ходаков Ю. В. Общая и неорганическая химия. Книга для учителя. — М.: Изд. Академии пед. наук РСФСР, 1954. — 524 с.
- Ходаков Ю. В., Эпштейн Д. А., Глориозов П. А. и др. Преподавание неорганической химии в средней школе. Методическое пособие для учителей. — М.: Просвещение, 1975. — 416 с. — (Методическая библиотека школы).
- Химия: Справ. изд./ В. Шретер, К.-Х. Лаутеншлегер, Х. Бибрак и др.: Пер. с нем. — М.: Химия, 1989.
Некоторые внешние ссылки в этой статье ведут на сайты, занесённые в спам-лист |