Dimetil sulfoksid
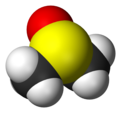
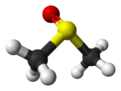
Dimetil sulfoksid (DMSO) je organosumporno jedinjenje sa formulom (CH3)2SO. Ova bezbojna tečnost je važan polarni aprotonski rastvarač koji rastvara polarna i nepolarna jedinjenja i meša se sa širokim nizom organskih rastvarača, kao i vodom. On prodire u kožu veoma brzo. Njegov ukus podseća na beli luk.[6]
| Dimetil sulfoksid | |||
|---|---|---|---|
 |
 | ||
| |||
| IUPAC ime |
| ||
| Naziv po klasifikaciji | Metan sulfinilmetan Dimetil(oksido)sumpor | ||
| Drugi nazivi | Metil sulfinilmetan Metil sulfoksid | ||
| Identifikacija | |||
| Abrevijacija | DMSO | ||
| CAS registarski broj | 67-68-5 | ||
| PubChem[1][2] | 679 | ||
| ChemSpider[3] | 659 | ||
| UNII | YOW8V9698H | ||
| EINECS broj | |||
| DrugBank | DB01093 | ||
| KEGG[4] | |||
| MeSH | |||
| ChEBI | 28262 | ||
| ChEMBL[5] | CHEMBL504 | ||
| RTECS registarski broj toksičnosti | PV6210000 | ||
| ATC code | G04,M02AX03 | ||
| Bajlštajn | 506008 | ||
| Gmelin Referenca | 1556 | ||
| Jmol-3D slike | Slika 1 Slika 2 | ||
| |||
| |||
| Svojstva | |||
| Molekulska formula | C2H6OS | ||
| Molarna masa | 78.13 g mol−1 | ||
| Agregatno stanje | bezbojna tečnost | ||
| Gustina | 1.1004 g cm-3 | ||
| Tačka topljenja |
19 °C, 292 K, 66 °F | ||
| Tačka ključanja |
189 °C, 462 K, 372 °F | ||
| Rastvorljivost u vodi | meša se | ||
| pKa | 35 | ||
| Indeks prelamanja (nD) | 1.479 εr = 48 | ||
| Viskoznost | 1.996 cP at 20 °C | ||
| Struktura | |||
| Dipolni moment | 3.96 D | ||
| Opasnost | |||
| Podaci o bezbednosti prilikom rukovanja (MSDS) | Oxford MSDS | ||
| Opasnost u toku rada | Iritant (Xi), zapaljiv (F) | ||
| NFPA 704 | |||
| R-oznake | R36/37/38 | ||
| S-oznake | S26, S37/39 | ||
| Tačka paljenja | 89 °C | ||
| Srodna jedinjenja | |||
| Srodna materije: sulfoksidi | dietil sulfoksid | ||
| Srodna jedinjenja | natrijum metilsulfinilmetilid, dimetil sulfid, dimetil sulfon, aceton | ||
|
Ukoliko nije drugačije napomenuto, podaci se odnose na standardno stanje (25 °C, 100 kPa) materijala | |||
| Infobox references | |||
Sinteza i proizvodnja
urediSintetizovao ga je ruski naučnik Aleksander Zaitsev 1866. godine, a svoje nalaze je objavio 1867. Dimetil sulfoksid je nusproizvod sulfatnog procesa. Oksidacija dimetil sulfida kiseonikom ili azot dioksidom daje DMSO.[7]
Primene
urediRastvarač
urediDMSO je polarni aprotonični rastvarač koji je manje toksičan nego drugi članovi ove klase, kao što su dimetilformamid, dimetilacetamid, N-metil-2-pirolidon, i HMPA. DMSO se često koristi kao rastvarač za hemijske reakcije u kojima učestvuju soli, na primer Finkelsteinove reakcije i druge nukleofilne supstitucije. On se ekstenzivno koristi kao ekstraktant u biohemiji i ćelijskoj biologiji.[8] Pošto je DMSO samo slabo kiseo, on toleriše relativno jake baze i kao takav se koristi u studijama karbanjona. pKa vrednosti u odsustvu vode (mere C-H, O-H, S-H i N-H kiselosti) za hiljade organskih jedinjenja su određene u DMSO rastvorima.[9][10]
Zvog svoje visoke tačke ključanja (189 °C; 462 K), DMSO sporo isparava pod normalnim atmosferskim pritiskom. Uzorci rastvoreni u DMSO-u se ne mogu lako povratiti u poređenju sa drugim rastvaračima, jer je veoma taško odstraniti sve tragove DMSO-a konvencionalnim rotacionim isparavanjem. Reakcije koje se izvode u DMSO-u se često razblažuju vodom da bi došlo do precipitacije ili fazne-separacije produkata. Relativno visoka tačka smrzavanja (18.5 °C; 292 K) čini DMSO čvrstim neposredno ispod sobne temperature, što ograničava njegovu upotrebljivost u nekim hemijskim procesima (npr. kristalizaciji sa hlađenjem).
DMSO nalazi sve veću primenu u proizvodnim procesima mikroelectronskih uređaja.[11] Zbog njegove sposobnosti rastvaranja mnogih vrsta jedinjenja, DMSO je uobičajeni rastvarač u menadžmentu hemikalija i testiranju visokog kapaciteta koji su integralini deo procesa razvoja lekova.[12]
Reakcije
urediSumporni centar DMSO-a je nukleofilan za slabe elektrofile, i kiseonik je nukleofilan za jake elektrofile. Metil grupe DMSO-a imaju umereno kiseli karakter (pKa=35) usled stabilizacije rezultirajućeg karbanjona S(O)R grupom, tako da ih deprotonizuju jake baze kao što je litijum diizopropilamid i natrijum hidrid. DMSO-ova natrijumska so formirana ovim putem („dimsil natrijum“) je korisna baza, npr. ona se često koristi za deprotonaciju ketona da bi se formirali natrijumski enolati, fosfonijumske soli, rezultat čega su Vitigovi reagensi, i formamidinijum soli koje formiraju diaminokarbene.
DMSO reaguje sa metil jodidom da formira trimetilsulfoksonijum jodid, [(CH3)3SO]I, koji se može deprotonovati natrijum hidridom da formira sumpor ilid:
- (CH3)2SO + CH3I → [(CH3)3SO]I
- [(CH3)3SO]I + NaH → [(CH3)2CH2SO + NaI + H2
U organskoj sintezi, DMSO se koristi kao blag oksidant.[13][14]
DMSO je uobičajeni ligand u koordinatnoj hemiji. Kompleks dihlorotetrakis(dimetil sulfoksid)rutenijum(II), RuCl2(dmso)4, sadrži DMSO vezan za rutenijum kroz sumpor i kroz kiseonik.
Reference
uredi- ↑ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today 15 (23-24): 1052-7. DOI:10.1016/j.drudis.2010.10.003. PMID 20970519.
- ↑ Evan E. Bolton, Yanli Wang, Paul A. Thiessen, Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry 4: 217-241. DOI:10.1016/S1574-1400(08)00012-1.
- ↑ Hettne KM, Williams AJ, van Mulligen EM, Kleinjans J, Tkachenko V, Kors JA. (2010). „Automatic vs. manual curation of a multi-source chemical dictionary: the impact on text mining”. J Cheminform 2 (1): 3. DOI:10.1186/1758-2946-2-3. PMID 20331846.
- ↑ Joanne Wixon, Douglas Kell (2000). „Website Review: The Kyoto Encyclopedia of Genes and Genomes — KEGG”. Yeast 17 (1): 48–55. DOI:10.1002/(SICI)1097-0061(200004)17:1<48::AID-YEA2>3.0.CO;2-H.
- ↑ Gaulton A, Bellis LJ, Bento AP, Chambers J, Davies M, Hersey A, Light Y, McGlinchey S, Michalovich D, Al-Lazikani B, Overington JP. (2012). „ChEMBL: a large-scale bioactivity database for drug discovery”. Nucleic Acids Res 40 (Database issue): D1100-7. DOI:10.1093/nar/gkr777. PMID 21948594.
- ↑ Novak, K. M., ur. (2002). Drug Facts and Comparisons (56th izd.). St. Louis, Missouri: Wolters Kluwer Health.. str. 619. ISBN 1574391100..
- ↑ Kathrin-Maria Roy “Sulfones and Sulfoxides” Ullmann's Encyclopedia of Industrial Chemistry 2002, Wiley-VCH, Weinheim. DOI:10.1002/14356007.a25_487
- ↑ „DMSO”. exactantigen.com. Arhivirano iz originala na datum 2009-10-05. Pristupljeno 2. 10. 2009.
- ↑ Bordwell FG (1988). „Equilibrium acidities in dimethyl sulfoxide solution”. Accounts of Chemical Research 21 (12): 456–463. DOI:10.1021/ar00156a004.
- ↑ „Bordwell pKa Table in DMSO”.
- ↑ Kvakovszky G, McKim AS, Moore J. (2007). „A Review of Microelectronic Manufacturing Applications Using DMSO-Based Chemistries”. The Electrochemical Society 11 (2): 227–234. DOI:10.1149/1.2779383.
- ↑ Balakin KV, Savchuk NP, Tetko IV. (2006). „In Silico Approaches to Prediction of Aqueous and DMSO Solubility of Drug-Like Compounds: Trends, Problems and Solutions”. Current Medicinal Chemistry 13 (2): 223–241. DOI:10.2174/092986706775197917. PMID 16472214.
- ↑ Epstein WW, Sweat FW (March 1967). „Dimethyl Sulfoxide Oxidations”. Chemical Reviews 67 (3): 247–260. DOI:10.1021/cr60247a001. PMID 6042131.
- ↑ Tidwell TT. (1990). „Oxidation of Alcohols by Activated Dimethyl Sulfoxide and Related Reactions: An Update”. Synthesis 1990 (10): 857–870. DOI:10.1055/s-1990-27036.
