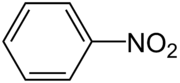
Nitrobenzén
| Tomuto článku alebo sekcii chýbajú odkazy na spoľahlivé zdroje, môže preto obsahovať informácie, ktoré je potrebné ešte overiť. Pomôžte Wikipédii a doplňte do článku citácie, odkazy na spoľahlivé zdroje. |
| Nitrobenzén | |
 | |
 | |
| Všeobecné vlastnosti | |
| Sumárny vzorec | C6H5NO2 |
| Systematický názov | Nitrobenzén |
| Fyzikálne vlastnosti | |
| Molárna hmotnosť | 123,06 g/mol |
| Rozpustnosť vo vode | 1,9 g/l (20 °C) |
| Teplota topenia | 5,85 °C |
| Teplota varu | 210,9 °C |
| Hustota | 1,199 g/cm3 (20 °C) |
| Teplota vzplanutia | 88 °C |
| Ďalšie informácie | |
| Číslo CAS | 98-95-3 |
| Pokiaľ je to možné a bežné, používame jednotky sústavy SI. Ak nie je hore uvedené inak, údaje sú za normálnych podmienok. | |
Nitrobenzén (zriedkavejšie nitrobenzol) je prudko jedovatá, mierne nažltlá kvapalina s charakteristickým zápachom. Racionálny vzorec nitrobenzénu je C6H5–NO2, nitroskupina je priamo viazaná na aromatickom jadre.

Fyzikálne vlastnosti
[upraviť | upraviť zdroj]Nitrobenzén je pri normálnych podmienkach bezfarebná resp. mierne nažltlá olejovitá kvapalina s charakteristickým horkomandľovým zápachom.
Chemické vlastnosti
[upraviť | upraviť zdroj]Nitroskupina je zaujímavá najmä z hľadiska väzbových pomerov. Tradičná štruktúra tejto skupiny nie je uspokojivá, pretože atómy kyslíka majú v nej nerovnocenné postavenie. Lepšiu predstavu o väzbách nitrobenzénu podáva delokalizácia elektrónov, čím sa obidva atómy kyslíka stanú rovnocenné.
Nitroskupina v molekule nitrobenzénu znižuje elektrónovú hustotu na aromaticom jadre (−M efekt), a preto prebiehajú elektrofilné substitučné reakcie pomerne ťažko, ale silnými nitračnými činidlami možno pripraviť aj trinitrobenzén.

Reakcie
[upraviť | upraviť zdroj]V laboratórnej i priemyselnej praxi sa hojne využíva redukcia nitrobenzénu, pretože voľbou podmienok reakcie je možné dosiahnuť rôzne produkty: anilín, fenylhydroxylamín, hydrazobenzén, azoxybenzén. Najväčší význam má redukcia v kyslom prostredí, je to metóda priemyselnej výroby anilínu:

