Beljakovina

Beljakovína je kompleksna organska molekula, polimer, sestavljen iz najmanj 50 verižno povezanih aminokislin. Razlikujemo enostavne beljakovine (proteíni) in sestavljene beljakovine s prostetično skupino (proteídi). Izraze beljakovina, protein, peptid in polipeptid se včasih uporablja kot sinonime, včasih pa z nekoliko prekrivajočimi se pomeni. Tako izraz protein večinoma označuje celo molekulo v stabilni obliki ali konformaciji, medtem ko peptid označuje krajši oligomer iz 20-30 aminokislin, ki nima stabilne 3D strukture.[1] Polipeptid je zgrajen iz poljubno dolge verige aminokislin, vendar se izraz spet večinoma uporablja za molekule brez definirane strukture.
Odkritje, poimenovanje in mejniki v raziskavah
[uredi | uredi kodo]V 18. stol. so naravoslovci, predvsem francoski kemik Antoine Fourcroy, odkrili nov tip organskih spojin, ki so koagulirale ob segrevanju ali ob prisotnosti kisline.[2] Tako so se obnašali albumini iz jajčnega beljaka, serumski albumin iz krvi in gluten iz žitaric. Iz tega zgodnjega odkritja prihaja slovensko poimenovanje - beljakovina. Izraz protein (iz grščine πρωτεῖος - proteios, prvovrsten, protos, prvi) je prvi uporabil švedski kemik Jöns Jacob Berzelius leta 1838, nizozemski kemik Gerardus Johannes Mulder pa je ugotovil, da imajo skoraj vsi proteini, ki so jih takrat poznali, empirično formulo C400H620N100O120P1S1,[3] zato je zmotno predvideval, da proteine sestavlja samo ena vrsta molekule.
Franz Hofmeister in Hermann Emil Fischer (Nobelov nagrajenec za kemijo leta 1902) sta neodvisno drug od drugega ugotovila, da so proteini polipeptidi, torej polimeri iz aminokislinskih monomer. Encimsko aktvnost proteinov je na primeru ureaze odkril James Batcheller Sumner (Nobelov nagrajenec za kemijo leta 1942) leta 1926. Sumner je bil tudi prvi, ki je uspel kristalizirati kak protein, kar je kasneje omogočilo določitev 3D strukture z metodo rentgenske kristalografije. [4] Frederick Sanger (Nobelov nagrajenec za kemijo 1958 in 1980) je prvi določil aminokislinsko zaporedje kake beljakovine - inzulina, leta 1949[5]. 3D struktura prvih beljakovin, hemoglobina in mioglobina, je bia določena leta 1958 (Max Perutz in John Cowdery Kendrew).[6] Danes so znane strukture skoraj 100 000-ih beljakovin, objavljenih v javnih podatkovnih zbirkah.
Zgradba
[uredi | uredi kodo]
V proteinskih molekulah so aminokisline med seboj povezane s peptidno vezjo. Peptidna vez nastane med aminoskupino ene in karboksilno skupino druge aminokisline, pri čemer se odcepi molekula vode. V protein vezano aminokislino imenujemo aminokislinski ostanek. Protein je običajno sestavljen iz verig več kot 100 aminokislin. Vsaka veriga nanizanih aminokislin ima na enem koncu prosto aminsko skupino (–NH2) – ta konec imenujemo N-konec ali aminski konec – na drugem koncu pa ima prosto karboksilno skupino (–COOH) – tu je karboksilni ali C-konec.
Proteini so običajno sestavljeni iz 20-ih različnih L-alfa-aminokislin, kot jih kodira standardni genetski kod. Le izjemoma so gradniki tudi kake druge aminokisline, na primer selenocistein (standardni oznaki Sec in U) in pri nekaterih arhejah pirolizin (Pyl in O). Po končani sintezi beljakovine na ribosomih se aminokisline včasih naknadno spremenijo (posttranslacijske spremembe), najpogosteje s pripenjanjem drugih molekul.
Struktura
[uredi | uredi kodo]
Zvijanje proteinov je posledica aminokislinskega zaporedja in pripenjanja drugih molekul po sintezi na ribosomih. Oblika proteina brez takih naknadnih sprememb se imenuje tudi nativna konformacija. Zvijanje proteinov včasih poteka ob pomoči molekulskih spremljevalcev ali šaperonov (ang. chaperone), ki so tudi sami proteinske molekule. Proteinsko strukturo opišemo na štirih nivojih:
- primarna struktura, zaporedje aminokislin
- sekundarna struktura, zaradi različnih oblik aminokislinskih gradnikov se posamezni deli stabilizirajo in povežejo z vodikovimi vezmi. Pri tem nastanejo lokalne strukture, ki jih razdelimo na alfa vijačnice, beta plošče in zanke.
- terciarna struktura, oblika posamezne molekule proteina. Stabilizirajo jo interakcije med posameznimi deli, ki so lahko bolj oddaljeni drug od drugega glede na primarno strukturo. Tako je v notranjosti molekule pogosto hidrofobno jedro, oddaljeni deli se povežejo z vodikovimi in disulfidnimi vezmi, posamezni deli so podvrženi posttranslacijskim spremembam. Terciarna struktura omogoča normalno delovanje proteina.
- kvartarna struktura, več molekul ali proteinskih podenot se poveže v proteinski kompleks.

Posamezen protein ni toga ali rigidna molekula, ampak lahko prehaja med različnimi oblikami ali konformacijami. To zlasti velja za encime, ki nekoliko spremenijo svojo obliko, ko se vežejo s substratom, ko katalizirajo v več stopnjah reakcijo in ko sprostijo produkte. Različna konformacija je lahko tudi posledica interakcije z drugimi proteini ali pa z dejavniki okolja (temperatura, pH).[7]
Določanje strukture
[uredi | uredi kodo]Običajni metodi za določanje strukture proteinov sta rentgenska kristalografija in NMR spektroskopija, pri obeh dobimo koordinate posameznih atomov. Primarno strukturo lahko napovemo že na osnovi zaporedij DNK, terciarno ni kvartarno pa s posebnimi programi, ki zahtevajo veliko procesorsko moč. Najbolj znan je projekt Folding@home, v katerega se vključujejo uporabniki preko spleta, tako da dajo na razpolago procesorsko moč svojega osebnega računalnika, ko le ta ni v uporabi.[8]
Sinteza
[uredi | uredi kodo]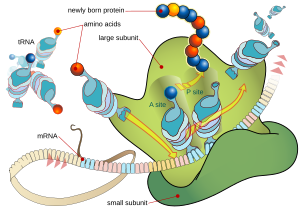
Biosinteza
[uredi | uredi kodo]Vsaka živa celica je sposobna sintetizirati beljakovine. Del zaporedja DNK se najprej prepiše (prepisovanje ali transkripcija) v RNK, ta pa se prevede (prevajanje ali translacija) v zaporedje aminokislin. Sinteza poteka na [ribosom]ih v citoplazmi celice, pri evkariontih se lahko proteini sintetizirajo tudi na citoplazemski strani endoplazemskega retikuluma in se po sintezi sprostijo na drugi strani. Sinteza vedno poteka od N- proti C-koncu[9] s hitrostjo do 20 aminokislin na sekundo pri prokariontih in nekoliko počasneje pri evkariontih.[10]
Velikost nastalega proteina se meri v številu aminokislin, ki ga sestavljajo, in po molekulski masi, običajno izraženi v daltonih (Da). Povprečen protein kvasovk sestavlja 466 aminokislin (53 kDa).[1] Največji znani proteini so sestavljeni iz skoraj 27 000 aminokislin (3000 kDa).[11]
Kemična sinteza
[uredi | uredi kodo]Peptidna sinteza omogoča proizvodnjo polipeptidov do dolžine 300 aminokislin, običajno v obratni smeri kot pri biosintezi, torej od C- proti N-koncu.[12] Zaradi omejitev pri dolžini končnega produkta in težav pri zvijanju v uporabno terciarno strukturo je kemična sinteza uporabna predvsem v laboratoriju, torej v biokemiji in celični biologiji.[13] Možno pa je vstavljanje nestandardnih aminokislin, zlasti takih, ki imajo pripete nase fluorescentne skupine.[14]
Funkcija
[uredi | uredi kodo]V organizmih
[uredi | uredi kodo]Beljakovine so osrednjega pomena za celično presnovo. Večina molekul v celici je inertnih, torej ne reagirajo z drugimi molekulami. Izjeme so določene molekule RNK, predvsem pa proteini, zlasti encimi. Pri bakteriji Escherichia coli proteini predstavljajo 50% suhe teže, DNA 3 % in RNA 20 %.[15]
Glede na funkcijo v celici jih delimo na:
- encime, ki katalizirajo kemične reakcije, na primer v procesih sinteze, razgradnje, regulacije izražanja DNK...
- proteine, ki sodelujejo v celični signalizaciji in vezavi ligandov, torej receptorji, protitelesa, hormoni
- strukturne proteine, zlasti vlaknati ali fibrinski proteini, ki dajejo obliko celici in organizmu. Primeri so kolagen, fibrin, keratin (lasje, nohti), aktin in miozin (mišice).
V industriji in izdelkih za široko uporabo
[uredi | uredi kodo]Verjetno najbolj znani encimi v široki uporabi so tisti v pralnih praških. Farmacevtska industrija proizvaja veliko proteinskih zdravil, najbolj znani so inzulin, rastni hormon in faktor VII (omogoča strjevanje krvi pri hemofilikih). Proteini so tudi v cepivih, bodisi kot antigeni ali kot protitelesa pri pasivni imunizaciji, na primer pri hemolitični bolezni novorojencev.
V laboratorijskih raziskavah
[uredi | uredi kodo]Encimi in protitelesa imajo širok spekter uporabe v laboratorijih, zlasti na področju molekularne biologije. Protitelesa se uporabljajo predvsem pri lokalizaciji neke snovi v preparatu in pri določanju koncentracije neke snovi v encimskoimunskem testu. V genetiki se uporablja različne encime za manipulacijo molekule DNK, kot so DNK-polimeraza (pomnoževanje), endonukleaze (rezanje znotraj zaporedja), ligaze (povezovanje verig) in druge.
Celoten nabor proteinov nekega organizma se imenuje proteom, veda, ki preučuje veliko različnih proteinov v organizmu pa je proteomika. Pri proteomskih raziskavah se med seboj ločuje posamezne proteine,[16] določa njihovo koncentracijo,[17] predvsem pa se preučuje interakcije med proteini.[18] Celoten nabor vseh možnih interakcij proteinov nekega organizma je interaktom.[19]
Beljakovine v prehrani
[uredi | uredi kodo]

Beljakovinska hrana
[uredi | uredi kodo]Večina mikroorganizmov in rastlin je sposobna sama sintetizirati vse aminokisline, živali vključno s človekom pa ne, zato jih morajo pridobiti s hrano.[15] Telo jih potrebuje za vgraditev v biomaso, lahko pa so tudi vir energije - gorivo, ki vsebuje 4 kcal/g (~ 17 kJ/g), podobno kot ogljikovi hidrati, a manj kot lipidi (9 kcal/g). Esencialne aminokisline so levcin, izolevcin, valin, lizin, treonin, triptofan, metionin, fenilalanin in histidin. Z raznoliko hrano dobimo dovolj esencialnih aminokislin, v določenih primerih pa so lizin, treonin, triptofan in žveplo vsebujoči aminokislini metionin in cistein limitirajoči faktorji. To pomeni, da če je teh aminokislin premalo, potem tudi drugih ne moremo izkoristiti. V tem primeru je treba v prehrano vključiti dodatna živila, ki vsebujejo več limitirajoče aminokisline. V spodnji tabeli so podatki v miligramih limitirajočega faktorja na gram proteinov iz določenega vira hrane. Z rumeno so označene najnižje, z zeleno pa najvišje vrednosti za posamezen vir.
| Vir hrane[20] | Lizin | Treonin | Triptofan | Žveplo vseb. aminokisline |
|---|---|---|---|---|
| Stročnice | 64 | 38 | 12 | 25 |
| Žita | 31 | 32 | 12 | 37 |
| Oreški in semena | 45 | 36 | 17 | 46 |
| Sadje | 45 | 29 | 11 | 27 |
| Meso | 85 | 44 | 12 | 38 |
Optimalna kombinacija proteinskih virov je pogojena glede na geografsko regijo, dostopnost, ceno, prebavljivost, kaloričnost, aminokislinsko sestavo ter seveda osebni okus in nazor (vegetarijanstvo, veganstvo, verski razlogi).[21] Na svetovnem nivoju proteini rastlinskega izvora prevladujejo s 60% nad proteini živalskega izvora. Živalski viri proteinov so meso, jajca, mleko in mlečni izdelki.[22] Glavni rastlinski viri so žita in stročnice, ki večinoma vsebujejo več kot 7% proteinov.[21] Proteinov v gomoljih, koreninah in sadežih je bistveno manj, med 0 in 2%. Hrano z nizko proteinsko vrednostjo je zato treba kombinirati s proteinsko bogato hrano, zlasti pri otrocih.[23][24]
Iz različnih virov je možno pridobiti proteine v velikih količinah v dokaj čisti suhi obliki. Taki pripravki so dodaten proteinski vir pri nekaterih športnikih, zlasti pri bodibilderjih.[25]
Koncentracijo proteinov v hrani se določa predvsem s Kjeldahlovo in Dumasovo metodo. Dejansko s tema metodama merimo vsebnost dušika v vzorcu, ki je v organizmih prisoten predvsem v aminokislinah, pa tudi v nukleinskih kislinah in sečnini, medtem ko ga v maščobah in ogljikovih hidratih praktično ni.[26] Ker metodi ne zaznavata tipa molekul, ki vsebujejo dušik, so v letih 2007 in 2008 na Kitajskem mleku dodajali dušično industrijsko kemikalijo melamin in tako navidezno izboljšali njegovo sestavo.[27][28] Zaradi tega so nekatere države uvedle spremenjene metode določanja proteinov v hrani, zlasti v mlečnih izdelkih.[29][30]
Priporočena dnevna doza
[uredi | uredi kodo]Zaradi raznolike prehrane po svetu in različnega načina življenja ni poenotene priporočene dnevne doze proteinov.[31] [32] Potrebna količina proteinov je tako odvisna od celotne potrebe po energiji, dušiku, esencialnih aminokislinah, pa tudi od telesne teže, fizične aktivnosti, zdravja in poškodb.[33][25][34] Potreba po proteinih je večja tudi v otroštvu, med nosečnostjo in dojenjem, pri okrevanju po operaciji in seveda v primerih stradanja in neustrezne prehrane.[35] Ob pomanjkanju energije in pri stradanju namreč telo porablja lastne proteine iz mišic. Ameriška in kanadska priporočena doza proteinov za ženske v starosti 19-70 let je 46 g/dan, za moške v isti starostni skupini pa 56 g/dan,[36] ali 0,8 g proteinov na kilogram telesne teže na dan.[31] Ta priporočila veljajo za zmerno aktivnost in ne upoštevajo porabe proteinov za energijo. Aktivni ljudje potrebujejo 1,6 - 1,8 g proteinov na kilogram telesne teže na dan.[32] V športu je pogosta tudi pretirana uporaba proteinov,[25] kar lahko povzroči zdravstvene težave, zlasti preobremenitev ledvic, povišano koncentracijo kalcija in sečnine v seču, poveča možnost nastanka ledvičnih kamnov.[37]
Prebava
[uredi | uredi kodo]Večina proteinov se v prebavnem traktu razgradi na posamezne aminokisline s pomočjo prebavnih encimov, kot sta pepsin in tripsin,[38] v tankem črevesju se posamezne aminokisline in zelo redko peptidne verige z več kot štirimi aminokislinami absorbirajo v telo. Nekateri proteini, zlasti rastlinskega izvora, so težje prebavljivi, zato se absorbira manjši del.[39] Tanko črevo dojencev lahko absorbira tudi nerazgrajene (mlečne) proteine.
Alergije
[uredi | uredi kodo]Specifični proteini pogosto sprožijo alergično reakcijo pri občutljivih posameznikih. Pogoste so zlasti alergije na kazein (mleko), gluten (pšenica in druga žita), ter na proteine v arašidih in drugih oreških. Alergično reakcijo povzročajo tudi jajca [beljak], simptomi so ščemenje v grlu in slabost.[40]
Sklici
[uredi | uredi kodo]- ↑ 1,0 1,1 Lodish H; Berk A; Matsudaira P; Kaiser CA; Krieger M; Scott MP; Zipurksy SL; Darnell J (2004). Molecular Cell Biology (5. izd.). New York: WH Freeman and Company.
- ↑ Osborne, Thomas B. (1909). The Vegetable Proteins, History. str. 1–6.
- ↑ Perrett, David (2007). »From 'protein' to the beginnings of clinical proteomics«. PROTEOMICS – CLINICAL APPLICATIONS. Wiley. 1 (8): 720–738. doi:10.1002/prca.200700525. ISSN 1862-8346. PMID 21136729.
- ↑ Sumner JB (1926). The isolation and crystallization of the enzyme urease. Preliminary paper Journal of Biological Chemistry 69 (2): 435–441.
- ↑ Sanger F (1949). The terminal peptides of insulin Biochemical Journal 45 (5): 563–574
- ↑ Muirhead H, Perutz M (1963). Structure of hemoglobin. A three-dimensional fourier synthesis of reduced human hemoglobin at 5.5 Å resolution Nature 199 (4894): 633–638
- ↑ van Holde & Mathews (1996), str. 368–375
- ↑ Scheraga, Harold A.; Khalili, Mey; Liwo, Adam (1. maj 2007). »Protein-Folding Dynamics: Overview of Molecular Simulation Techniques«. Annual Review of Physical Chemistry. Annual Reviews. 58 (1): 57–83. doi:10.1146/annurev.physchem.58.032806.104614. ISSN 0066-426X. PMID 17034338.
- ↑ van Holde & Mathews (1996), str. 1002–1042
- ↑ Dobson CM (2000). The nature and significance of protein folding. Pain RH (ed.). Mechanisms of Protein Folding. Oxford, Oxfordshire: Oxford University Press. pp. 1–28.
- ↑ Fulton A, Isaacs W (1991). Titin, a huge, elastic sarcomeric protein with a probable role in morphogenesis BioEssays 13 (4): 157–161
- ↑ Kent SB (2009). Total chemical synthesis of proteins Chemical Society Reviews 38 (2): 338–351
- ↑ Bruckdorfer, Thomas; Marder, Oleg; Albericio, Fernando (1. februar 2004). »From Production of Peptides in Milligram Amounts for Research to Multi-Tons Quantities for Drugs of the Future«. Current Pharmaceutical Biotechnology. 5 (1): 29–43. doi:10.2174/1389201043489620. ISSN 1389-2010. PMID 14965208.
- ↑ Schwarzer, Dirk; Cole, Philip A (2005). »Protein semisynthesis and expressed protein ligation: chasing a protein's tail«. Current Opinion in Chemical Biology. 9 (6): 561–569. doi:10.1016/j.cbpa.2005.09.018. PMID 16226484.
- ↑ 15,0 15,1 Voet D; Voet JG (2004). Biochemistry. Zv. 1 (3. izd.). Hoboken, NJ: Wiley.
- ↑ Görg, Angelika; Weiss, Walter; Dunn, Michael J. (15. november 2004). »Current two-dimensional electrophoresis technology for proteomics«. Proteomics. 4 (12): 3665–3685. doi:10.1002/pmic.200401031. PMID 15543535.
- ↑ Joos, Thomas (2009). »Protein microarrays: potentials and limitations«. Frontiers in Bioscience. 14 (11): 4376. doi:10.2741/3534.
- ↑ Koegl, M.; Uetz, P. (22. januar 2008). »Improving yeast two-hybrid screening systems«. Briefings in Functional Genomics and Proteomics. 6 (4): 302–312. doi:10.1093/bfgp/elm035.
- ↑ Plewczyński, Dariusz; Ginalski, Krzysztof (1. januar 2009). »The interactome: Predicting the protein-protein interactions in cells«. Cellular and Molecular Biology Letters. 14 (1): 1–22. doi:10.2478/s11658-008-0024-7. PMID 18839074.
- ↑ Amino acid content of foods and biological data on proteins (FAO nutritional studies number 24) Organizacija ZN za prehrano in kmetijstvo. 1985.
- ↑ 21,0 21,1 Young, V R; Pellett, P L (1. maj 1994). »Plant proteins in relation to human protein and amino acid nutrition«. The American Journal of Clinical Nutrition. 59 (5): 1203S–1212S. doi:10.1093/ajcn/59.5.1203s.
- ↑ New protein foods in human health: nutrition, prevention and therapy. Steinke, Waggle et al., CRC Press, 1992, p 91–100
- ↑ Hermann, Janice R. Protein and the Body Arhivirano 2019-11-23 na Wayback Machine. Oklahoma Cooperative Extension Service, Division of Agricultural Sciences and Natural Resources, Oklahoma State University.
- ↑ Michael C. Latham (1997). Human nutrition in the developing world Food and Agriculture Organization of the United Nations.
- ↑ 25,0 25,1 25,2 Lemon, Peter W. R. (1995). »Do Athletes Need More Dietary Protein and Amino Acids?«. International Journal of Sport Nutrition. 5 (s1): S39–S61. doi:10.1123/ijsn.5.s1.s39. PMID 7550257.
- ↑ McClements Analysis of Proteins University of Massachusetts Amherst
- ↑ Toxic milk toll rockets in China BBC, 15. september, 2008
- ↑ Stephen Chen (18. september, 2008). "Melamine – an industry staple". South China Morning Post (Hong Kong)
- ↑ P.M. VanRaden and R.L. Powell. Genetic evaluations for true protein Arhivirano 2007-07-08 na Wayback Machine. United States Department of Agriculture.
- ↑ Snyder, Alison Protein Pretense: Cheating the standard protein tests is easy, but industry hesitates on alternatives Scientific American, 2007, 297, 18 - 20
- ↑ 31,0 31,1 Bilsborough, Shane; Mann, Neil (2006). »A Review of Issues of Dietary Protein Intake in Humans«. International Journal of Sport Nutrition and Exercise Metabolism. 16 (2): 129–152. doi:10.1123/ijsnem.16.2.129. PMID 16779921.
- ↑ 32,0 32,1 Lemon, Peter W.R. (2000). »Beyond the Zone: Protein Needs of Active Individuals«. Journal of the American College of Nutrition. 19 (sup5): 513S–521S. doi:10.1080/07315724.2000.10718974. PMID 11023001.
- ↑ Genton, Laurence; Melzer, Katarina; Pichard, Claude (2010). »Energy and macronutrient requirements for physical fitness in exercising subjects«. Clinical Nutrition. 29 (4): 413–423. doi:10.1016/j.clnu.2010.02.002. PMID 20189694.
- ↑ Tarnopolsky, M. A.; Atkinson, S. A.; MacDougall, J. D.; Chesley, A.; Phillips, S.; Schwarcz, H. P. (1. november 1992). »Evaluation of protein requirements for trained strength athletes«. Journal of Applied Physiology. 73 (5): 1986–1995. doi:10.1152/jappl.1992.73.5.1986. PMID 1474076.
- ↑ Svetovna zdravstvena organizacija, Organizacija ZN za prehrano in kmetijstvo, United Nations University (2007). Protein and amino acid requirements in human nutrition Arhivirano 2015-06-27 na Wayback Machine. WHO Press.
- ↑ Dietary reference intakes: macronutrients Arhivirano 2009-01-17 na Wayback Machine. Institute of Medicine
- ↑ Food and Nutrition Board (2005). A Report of the Panel on Macronutrients, Subcommittees on Upper Reference Levels of Nutrients and Interpretation and Uses of Dietary Reference Intakes, and the Standing Committee on the Scientific Evaluation of Dietary Reference Intakes Dietary Reference Intakes for Energy, Carbohydrate, Fiber, Fat, Fatty Acids, Cholesterol, Protein, and Amino Acids (Macronutrients). The National Academies Press, Washington, D.C.
- ↑ »Digestion of Dietary Proteins in the Gastro-Intestinal Tract«. Arhivirano iz prvotnega spletišča dne 28. junija 2017. Pridobljeno 29. januarja 2014.
- ↑ Gaudichon, Claire; Bos, Cécile; Morens, Céline; Petzke, Klaus J.; Mariotti, François; Everwand, Julia; Benamouzig, Robert; Daré, Sophie; Tomé, Daniel; Metges, Cornelia C. (2002). »Ileal losses of nitrogen and amino acids in humans and their importance to the assessment of amino acid requirements«. Gastroenterology. 123 (1): 50–59. doi:10.1053/gast.2002.34233. PMID 12105833.
- ↑ Allergy types, food allergies WebMD
Viri
[uredi | uredi kodo]- Van Holde KE; Mathews CK (1996). Biochemistry. Menlo Park: Benjamin/Cummings Pub. Co., Inc. ISBN 978-0-8053-3931-4.
