锡
锡[注 1](英语:Tin),是一种化学元素,其化学符号为Sn(源于拉丁语:Stannum),原子序数为50,原子量为118.710 u,是贫金属。纯锡有银灰色的金属光泽,有良好的伸展性能,在空气中不易氧化;其多种合金有防腐蚀的性能,因此常用来作为其它金属的防腐层。锡的主要来源是它的一种氧化物矿物锡石(SnO2),盛产于中国云南、马来西亚、印尼等地。
| 外观 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
银白色金属 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 概况 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 名称·符号·序数 | 锡(tin)·Sn·50 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 元素类别 | 贫金属 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 族·周期·区 | 14·5·p | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 标准原子质量 | 118.710(7)[1] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
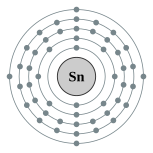
| 电子排布 | [Kr] 4d10 5s2 5p2 2, 8, 18, 18, 4 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 历史 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 发现 | 约公元前3500年 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 物理性质 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 物态 | 固态 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 | (接近室温) (白锡) 7.365 g·cm−3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 | (接近室温) (灰锡) 5.769 g·cm−3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熔点时液体密度 | 6.99 g·cm−3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熔点 | 505.08 K,231.93 °C,449.47 °F | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 沸点 | 2875 K,2602 °C,4716 °F | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熔化热 | (白锡) 7.03 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 汽化热 | (白锡) 296.1 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 比热容 | (白锡) 27.112 J·mol−1·K−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
蒸气压
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子性质 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 氧化态 | 4, 3[2], 2, 1[3], -4 (两性) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 电负性 | 1.96(鲍林标度) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 电离能 | 第一:708.6 kJ·mol−1 第二:1411.8 kJ·mol−1 第三:2943.0 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子半径 | 140 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 共价半径 | 139±4 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 范德华半径 | 217 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 杂项 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 晶体结构 | 四方
(白锡) (灰锡) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 磁序 | (灰锡) 抗磁性[4], (白锡) 顺磁性 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 电阻率 | (0 °C)115 n Ω·m | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 热导率 | 66.8 W·m−1·K−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 膨胀系数 | (25 °C)22.0 µm·m−1·K−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 声速(细棒) | (室温)(rolled) 2730 m·s−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 杨氏模量 | 50 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 剪切模量 | 18 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 体积模量 | 58 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 泊松比 | 0.36 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 莫氏硬度 | 1.5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 布氏硬度 | ~350 MPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS号 | 7440-31-5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 同位素 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
主条目:锡的同位素
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
主要特征
编辑物理特性
编辑锡是可延展、柔软、高度结晶状、银白色的金属。当锡棒弯曲时,由于锡晶体是孪晶,可以听到称为锡鸣的爆裂声。[5]
锡在温度达到3.72K以下时成为超导体。[6]事实上,锡是最早被研究的超导体之一;超导体的特性之一——迈斯纳效应,就是首先在锡晶体上发现的。[7]
同素异形体
编辑在常压下锡有2种同素异形体。以灰锡(α锡)、白锡(β锡)的状态存在。
在室温,是常见的银白色金属白锡,富有延展性。白锡的晶体为正方晶结构,呈金属性,比重较灰锡重。当温度回降到低于13.2℃的话,它会慢慢变为粉末状的灰锡。灰锡的晶体结构是与钻石、硅和锗类似的钻石型晶体结构。灰锡因为其原子间形成了共价结构,电子不能自由转移,故而没有任何金属性。灰锡是暗灰色的粉状物,除了一些非常特殊的半导体应用,日常用途不大。[5]在低温下,白锡转化为灰锡的现象常被称为锡疫。[注 2]这个现象最早由亚里士多德发现。未染上“锡疫”的锡板,一旦和有“锡疫”的锡板接触,也会产生灰色的斑点而逐渐“腐烂”掉。这个过程的转化温度会因存在杂质如铝和锌而降低。在锡中加入锑或铋可以防止锡的退化,促进锡的延展性。[9]这是由于铋原子中有多余的电子可供锡的结晶点阵,使锡的晶体结构稳定化,完全消除“锡疫”的可能性。
锡的另外两种同素异形体γ锡和σ锡,只存在于温度高于161℃ (322℉)和压力大于几个GPa的环境中。[10]
化学性质
编辑锡受水的锈蚀的影响很小,但易被酸和碱腐蚀。锡可以被高度的抛光,可被用作其他金属的保护层。[5]锡表面会形成保护性的氧化层以防止进一步的氧化。白锡和其他的锡合金表面都会形成这样的保护层。[11]当氧气存在于溶液中时,锡会变成一种催化剂,加速化学腐蚀。[5]
在空气中加热后锡可以形成SnO2。SnO2是弱酸性的。与熔融碱反应可以形成锡酸盐。它可以直接与氯和氧反应。在稀酸中它可以取代氢离子。
- 作为金属,可氧化至二价锡和较稳定的四价锡。
同位素
编辑锡有10种稳定的同位素,是所有化学元素中稳定同位素最多的。此外锡还有61种不稳定同位素。
用途
编辑锡很容易与铁结合,它被用来做铅、锌和钢的防腐层。涂锡的钢罐多用于贮藏食物,这是金属锡的一个重要用途。
其它用途:
- 锡是一些重要合金如青铜、巴氏合金等的组成部分。
- 氯化锡在印刷术中被用作一种还原剂和媒染剂。锡盐喷在玻璃上可以形成导电的涂层。这些涂层被用在防冻玻璃上。
- 一般玻璃板是将熔化的玻璃浇在锡板上形成的,来保证玻璃面的平坦和光滑。
- 焊锡含锡用来连接管道和电子线路,此外锡还被用在多种化学反应中。
- 可镀于铜和铁上,镀锡的铁片称为马口铁;可防锈、制作罐头容器。
- 有机锡可作为有机化合物的合成的试剂,作用包括还原官能团、造成自由基及令有机份子重新排列。
在3.75K的低温下,锡晶体可成为超导体,也是最早被发现的超导体之一,超导体的一个特别特征迈斯纳效应便是首先在锡晶体中被发现。由于铌-锡-混合物(Nb3Sn)拥有较高的临界温度(18K)和较高的临界磁场(25特斯拉),它常被用来制作商用超导电磁铁的导线,一个数千克重的超导电磁铁可以产生一个数吨重的普通电磁铁所产生之磁场。
全球年锡用量约为30万吨,其中约35%用作焊锡,30%用为锡片和30%用为化学原料或颜色。由于越来越多的锡-铅-焊锡被无铅焊锡(含95%以上的锡)代替,全球的锡用量每年约提高10%。2003年在伦敦金属交易所,锡的价格为每吨五千美元左右,2004年的价格达每吨八千到一万美元。
自1992年起,美国立法禁止包装产品中使用铅、汞、镉及六价铬这四种有毒金属。全球著名的红酒封套生产商拉蒙丁(RAMONDIN)公司便开始使用锡作为以上有毒金属的替代品,此种锡封套是当今红酒封套制造业中的领先技术且无法被轻易复制,因此成为保护红酒品牌及产品的一种有效途径。
历史
编辑锡是人类知道最早的金属之一,从古代开始它就是青铜的组成部分之一。早在公元前3000年左右,人们就用锡来硬化铜。约从前7世纪开始人类认识到纯的锡。于战国时期就开始用来作武器的主要材料。
今天有时锡这个词也被用在没有锡或只有很少锡的物体上。比如许多“锡纸”实际上是铝纸。大多数锡罐实际上是钢罐,上面涂有一层非常薄的锡。
来源
编辑全世界约有35个国家产锡。几乎每个洲都有重要的产锡国。
在地壳中锡比较稀少,只占地壳的百万分之二,今天的锡矿的产量可能还可以维持约35年[来源请求]。80%锡矿是沉积岩,至少半数的锡来自东南亚(从中国中部经泰国到印度尼西亚)。
最重要的锡矿石是锡石(SnO2),锡矿中的原矿石含约5%的锡,首先矿石要被粉碎和用不同的方式提纯,提纯后的锡矿含75%的锡。在精炼炉中锡从其矿物中用碳还原出来。精炼炉中的温度稍高于锡的熔点,而杂质的熔点比这个温度要高,因此还原的锡可以从炉中流出。少量锡来自它的硫化物如圆柱锡石、硫银锡矿和硫锡铅矿等。越来越多的锡是回收来的。
中国的锡产量占全世界的30%,其它东南亚国家一起占30%,南美洲占20%。
生理作用
编辑金属锡即使大量也是无毒的,简单的锡化合物和锡盐的毒性相当低,但一些有机锡化物的毒性非常高。尤其锡的三烃基化合物被用作船的漆来杀死附在船身上的微生物和贝壳。这些化合物可以摧毁含硫的蛋白质。
注释
编辑参考资料
编辑- ^ Prohaska, Thomas; Irrgeher, Johanna; Benefield, Jacqueline; Böhlke, John K.; Chesson, Lesley A.; Coplen, Tyler B.; Ding, Tiping; Dunn, Philip J. H.; Gröning, Manfred; Holden, Norman E.; Meijer, Harro A. J. Standard atomic weights of the elements 2021 (IUPAC Technical Report). Pure and Applied Chemistry. 2022-05-04. ISSN 1365-3075. doi:10.1515/pac-2019-0603 (英语).
- ^ SnH3. NIST Chemistry WebBook. National Institure of Standards and Technology. [23 January 2013]. (原始内容存档于2017-06-30).
- ^ HSn. NIST Chemistry WebBook. National Institute of Standards and Technology. [23 January 2013]. (原始内容存档于2017-06-30).
- ^ Magnetic susceptibility of the elements and inorganic compounds 互联网档案馆的存档,存档日期2012-01-12., in Lide, D. R. (编), CRC Handbook of Chemistry and Physics 86th, Boca Raton (FL): CRC Press, 2005, ISBN 0-8493-0486-5
- ^ 5.0 5.1 5.2 5.3 Holleman, Arnold F.; Wiberg, Egon; Wiberg, Nils;. Tin. Lehrbuch der Anorganischen Chemie 91–100. Walter de Gruyter. 1985: 793–800. ISBN 3-11-007511-3 (德语).
- ^ Dehaas, W; Deboer, J; Vandenberg, G. The electrical resistance of cadmium, thallium and tin at low temperatures. Physica. 1935, 2: 453. Bibcode:1935Phy.....2..453D. doi:10.1016/S0031-8914(35)90114-8.
- ^ Meissner, W.; R. Ochsenfeld. Ein neuer effekt bei eintritt der supraleitfähigkeit. Naturwissenschaften. 1933, 21 (44): 787–788. Bibcode:1933NW.....21..787M. doi:10.1007/BF01504252.
- ^ Le Coureur, Penny; Burreson, Jay. Napoleon's Buttons: 17 Molecules that Changed History. New York: Penguin Group USA. 2004.
- ^ Schwartz, Mel. Tin and Alloys, Properties. Encyclopedia of Materials, Parts and Finishes 2nd. CRC Press. 2002. ISBN 1-56676-661-3.
- ^ Molodets, A. M.; Nabatov, S. S. Thermodynamic Potentials, Diagram of State, and Phase Transitions of Tin on Shock Compression. High Temperature. 2000, 38 (5): 715–721. doi:10.1007/BF02755923.
- ^ Craig, Bruce D; Anderson, David S; International, A.S.M. Handbook of corrosion data. 1995-01: 126 [2013-09-04]. ISBN 978-0-87170-518-1. (原始内容存档于2021-05-02).
延伸阅读
编辑[编]
外部链接
编辑- 元素锡在洛斯阿拉莫斯国家实验室的介绍(英文)
- EnvironmentalChemistry.com —— 锡(英文)
- 元素锡在The Periodic Table of Videos(诺丁汉大学)的介绍(英文)
- 元素锡在Peter van der Krogt elements site的介绍(英文)
- WebElements.com – 锡(英文)