Dušikovi oksidi
Pojam dušikovi oksidi odnosi se na binarne spojeve oksigena i dušika, ili na smjesu sljedećih spojeva:
- dušik-oksid
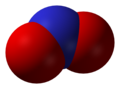
- Dušik-monoksid (NO), dušik (II) oksid
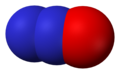
- Dušik-dioksid (NO2), dušik (IV) oksid
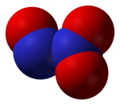
- Dušik-suboksid (N2O), dušik (I) oksid
- Didušik-trioksid (N2O3), dušik (II, IV) oksid
- Didušik-tetroksid (N2O4), dušik (IV) oksid
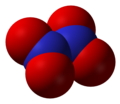
- Didušik-pentoksid (N2O5), dušik (V) oksid
Posljednja tri su nestabilni spojevi.
Tu spadaju i:
- Trinitramid (N(NO2)3 or N4O6), dušik(0,IV) oksid
- Dinitramid (N(NO2)3-)
- Nitrit (NO−
2) - Nitrat (NO−
3) - Nitronij (NO+
2) - Nitrozonij (NO+)
- Peroksinitrit (ONO−
2)
Spojevi NO i NO2 su radikali. Osim toga, postoji nekoliko aniona dušičnih oksida. Najstabilniji od njih je nitratni anion:
- Nitrat (NO3-), trioksonitratni (V) ion ali drugi dušik oksoanion uključuje nitrit, peroksinitrit, trioksodinitrat (hiponitrat) i nitroksilat.[1][2]
U hemiji atmosfere, Zagađivanju zraka i srodnim područjima , termin dušikovi oksidi specifično se odnosi na NOx (NO i NO2)[3]
Samoprva tri spoja izolirana su na sobnoj temperaturi. N2O3, na kojoj se N2O4 i N2O5 brzo se raspadaj. NO3, N4O i N(NO2)3 vrlo su reactivni.
N2O je stabilan i prilično nereaktivan na sobnoj temperaturi, a ne i NO2 je dosta reaktivan, ali ipak prilično stabilan kada je izoliran.
-
Dušik-okid, NO -
Dušik-dioksid, NO2 -
dušik-suboksid, N2O -
Didušik-trioksid, N2O3 -
Didušik-tetroksid, N2O4 -
Didušik-pentoksid, N2O5 -
Trinitramid, N(NO2)3
NOx
[uredi | uredi izvor]NOx (često pisan kao NOx) odnosi se naNO i NO2. Oni se proizvode u sagorijevanju, a posebno na visokoj temperaturi. Ove dvije hemikalije su važne vrste tragovima u Zemljinoj atmosferi. U troposferi, tokom dana, NO reagira s djelomično oksidiranim organskim vrstama (ili peroksidnim radikalima) i formira se NO2, koji se zatim fotolizira po suncu za pretvaranje NO:
- NO + CH3O2 → NO2 + CH3O
- NO2 + sunlight → NO + O
Atom kisika koji je nastao u drugoj reakciji zatim nastavlja da formira ozon; ova serija reakcija je glavni izvor troposferskog ozona. CH3O2je samo jedan primjer od mnogih djelomično oksidiranih organskih molekula koje mogu reagirati sa NO i formirati NO2.
Ove reakcije su prilično brrze, tako da NO i NO2 idu u krug, ali zbir njihovih koncentracija([NO] + [NO2]) ima tendenciju da ostane stabilan. Zbog ovog kruženja, može se razmišljati o dvije hemikalije kao grupe; otuda izraz NOx. Osim toga, djeluje kao glavni prekursori za troposferski ozon, NOx koji je također štetan za ljudsko zdravlje i ljudska prava.
NOx može reagirati s vodom dajući dušičastu kiselinu, koja može završiti u zemljištu, gdje tvori nitrate, koji se koriste za rastuće biljke.
Također pogledajte
[uredi | uredi izvor]Reference
[uredi | uredi izvor]- ^ Petrucci R. H., Harwood W. S., Herring F. G. (2002). General Chemistry, 8th Ed. New York: Prentice-Hall. ISBN 0-13-014329-4.CS1 održavanje: više imena: authors list (link)
- ^ Voet D, Voet J. . (1995). Biochemistry, 2nd Ed. Wiley.CS1 održavanje: upotreba parametra authors (link)
- ^ Seinfeld, John H.; Pandis, Spyros N. (1997), Atmospheric Chemistry and Physics: From Air Pollution to Climate Change, Wiley-Interscience, ISBN 0-471-17816-0