Vodik-peroksid
Ovom članku potrebna je jezička standardizacija, preuređivanje ili reorganizacija. |
| Vodik-peroksid | |
|---|---|
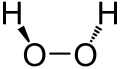 | |
| Općenito | |
| Hemijski spoj | Vodik-peroksid |
| Druga imena | Dioksidan Oksidanil |
| Molekularna formula | H2O2 |
| CAS registarski broj | 7722-84-1 |
| SMILES | OO |
| Osobine1 | |
| Molarna masa | 34,0147 g/mol |
| Agregatno stanje | Tečnost |
| Tačka topljenja | -0,43 °C |
| Tačka ključanja | 150,2 °C |
| Pritisak pare | 1.267 J/g K (gas) 2.619 J/g K (tečnost) |
| Rastvorljivost | Rastvorljiv u etru; miješa se |
| Dipolni moment | 2.26 D |
| Rizičnost | |
| NFPA 704 | |
| 1 Gdje god je moguće korištene su SI jedinice. Ako nije drugačije naznačeno, dati podaci vrijede pri standardnim uslovima. | |

Vodik-peroksid (H2O2) – u razblaženoj formi – je plavičasti ili bezbojni, tečni spoj vodika i kisika. U vodenim rastvorima je slaba kiselina, koja disocira u dva stepena. Njegove soli su metalni peroksidi.[1][2][3][4]

Struktura
[uredi | uredi izvor]Vodik-peroksid je neplanarna molekula sa uvrnutom C2 simetrijom. Veza O−O je jednostruka, a molekula ima relativno visoku rotacijsku barijeru 2460 cm−1 (29,45 kJ/mol). Poređenja radi, rotacijska barijera etana je 12,5 kJ/mol. Povećana barijera se pripisuje odbijanju između usamljenog para susjednih atoma kisika, što rezultira da vodik-peroksid ispoljava atropizomerizam.
Molekularne strukture plinovitog i kristalnog H2O2 značajno se razlikuju. Ova razlika se pripisuje efektima prisustva/odsustva vodikove veze, koja je odsutna u plinovitom stanju.[5] Kristali su tetragonalni sa grupom za ratmak; .
| Naziv | Formula | Molekulska masa (g/mol) | Tt (°C) | Tk (°C) |
|---|---|---|---|---|
| Vodik-peroksid | HOOH | 34.01 | −0.43 | 150.2* |
| Voda | HOH | 18.02 | 0.00 | 99.98 |
| Vodik-disulfid | HSSH | 66.15 | −89.6 | 70.7 |
| Hidrazin | H2NNH2 | 32.05 | 2 | 114 |
| Hidrokslamin | NH2OH | 33.03 | 33 | 58* |
| Difosfan | H2PPH2 | 65.98 | −99 | 63.5* |
Dobijanje
[uredi | uredi izvor]| H2O2 (w/w) | Gustoća (g/cm3) | Temperatura (°C) |
|---|---|---|
| 3% | 1,0095 | 15 |
| 27% | 1,10 | 20 |
| 35% | 1,13 | 20 |
| 50% | 1,20 | 20 |
| 70% | 1,29 | 20 |
| 75% | 1,33 | 20 |
| 96% | 1,42 | 20 |
| 98% | 1,43 | 20 |
| 100% | 1,450 | 20 |
Ranije se vodik-peroksid uglavnom dobijao elektrolizom sumporne kiseline:
U laboratorijskim uvjetima, dobija se reakcijom peroksida sa kiselinama. Historijski važan reagens je barij-peroksid, koji reagira u rastvoru sumporne kiseline, gradeći vodik-peroksid i barij-sulfat:
- Δf0gas: −136,11 kJ/mol
- Δf0liq: −188 kJ/mol
- Δf0sol: −200 kJ/mol
Historija
[uredi | uredi izvor]Vodik-peroksid je prvi put dobio Louis Jacques Thénard 1918. godine u reakciji barij-peroksida i dušične kiseline. Dodavanje hlorovodične kiseline, a kasnije se pokazalo potom i reakcija sa sumpornom kiselinom, bila je posebno dobro rješenje jer se tom prilikom izdvaja barij-sulfat.
Upotreba
[uredi | uredi izvor]Vodik-peroksid se upotrebljava za izbjeljivanje (između ostalog, i kose), kao antiseptik, u hemijskoj industriji, a i kao oksidans za raketno gorivo.
U prodaju dolazi u komercijalnim koncentracijama od 3,6,9,12, i 30% (pod nazivom "Perhidrol"; u apotekama je poznatiji kao "Hidrogen").
Također pogledajte
[uredi | uredi izvor]Reference
[uredi | uredi izvor]- ^ Petrucci R.H., Harwood W.S. and Herring F.G. (2002): General Chemistry, 8th Ed. Prentice-Hall, New York, ISBN 0-13-014329-4.
- ^ Laidler K. J. (1978): Physical chemistry with biological applications. Benjamin/Cummings, Menlo Park, ISBN 0-8053-5680-0.
- ^ Atkins P., De Paula J. (2006): Physical chemistry, 8th Ed. W. H. Freeman, San Francisco, ISBN 0-7167-8759-8
- ^ Binder H. H. (1999): Lexikon der chemischen Elemente. S. Hirzel Verlag, Stuttgart, ISBN 3-7776-0736-3.
- ^ Dougherty D. A., Anslyn E. V. (2005): Modern physical organic chemistry. University Science, ISBN 1-891389-31-9.









