1-propanol
| 1-propanol | |
|---|---|
 Strukturní vzorec 1-propanolu | |
| Obecné | |
| Systematický název | Propan-1-ol |
| Triviální název | Propanol |
| Ostatní názvy | n-propanol, propylalkohol |
| Anglický název | 1-Propanol |
| Německý název | 1-Propanol |
| Funkční vzorec | CH3CH2CH2OH |
| Sumární vzorec | C3H8O |
| Vzhled | bezbarvá kapalina |
| Identifikace | |
| Registrační číslo CAS | 71-23-8 |
| EC-no (EINECS/ELINCS/NLP) | 200-746-9 |
| Indexové číslo | 603-003-00-0 |
| SMILES | CCCO |
| Vlastnosti | |
| Molární hmotnost | 60,1 g/mol |
| Teplota tání | −126,5 °C |
| Teplota varu | 97,1 °C (370,3 K) |
| Hustota | 0,803 4 g/cm³ (kapalina) |
| Viskozita | 1,938 cP (25 °C) |
| Disociační konstanta pKa | (~16) |
| Rozpustnost ve vodě | neomezená |
| Struktura | |
| Dipólový moment | 1,68 D |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| H-věty | H225 H318 H336 |
| R-věty | R11, R41, R67 |
| S-věty | S2, S7, S16, S24, S26, S39 |
| NFPA 704 |  3
1
|
| Teplota vznícení | 15 °C |
Některá data mohou pocházet z datové položky. | |
Propan-1-ol (též 1-propanol, n-propanol, 1-propylalkohol, n-propylalkohol, nebo jednoduše propanol či propylalkohol) je primární alkohol s chemickým vzorcem CH3CH2CH2OH. Je izomerem propan-2-olu (isopropylalkoholu). Používá se jako rozpouštědlo ve farmaceutickém průmyslu, do pryskyřic a celulózových esterů. V malých dávkách vzniká přirozeně při mnoha fermentačních procesech.
Chemické vlastnosti
[editovat | editovat zdroj]1-propanol vykazuje normální chování primárního alkoholu. Proto ho lze převést na alkylhalogenidy. Například červený fosfor a jod tvoří n-propyljodid s 90% výtěžností, zatímco chlorid fosforečný s katalyzátorem chloridem zinečnatým dává 1-chlorpropan. Reakce s kyselinou octovou za přítomnosti kyseliny sírové jako katalyzátoru a podmínek Fischerovy esterifikace poskytuje propylacetát, kdežto flegmace propanolu s kyselinou mravenčí může poskytovat propylformát s výtěžností 65 %. Oxidace 1-propanolu dichromanem sodným a H2SO4 dává pouze 36% výtěžnost propionaldehydu a proto se pro tento typ reakce doporučují metody s vyšší výtěžností, za použití PCC nebo Swernovy oxidace. Oxidace kyselinou chromovou poskytuje kyselinu propionovou.
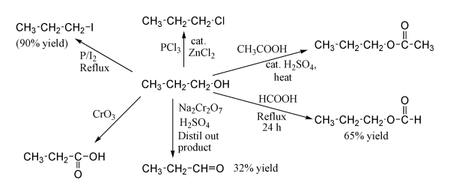
Příprava
[editovat | editovat zdroj]1-propanol je hlavní složkou přiboudliny, vedlejšího produktu určitých aminokyselin při fermentaci brambor a obilí na ethanol. Toto ale není významným zdrojem propanolu.
1-propanol se vyrábí katalytickou hydrogenací propionaldehydu. Propionaldehyd se pak vyrábí oxosyntézou, hydroformylací ethenu oxidem uhelnatým a vodíkem za přítomnosti katalyzátoru, např. dikobaltoktakarbonylového nebo rhodiového komplexu.
- (1) H2C=CH2 + CO + H2 → CH3CH2CH=O
- (2) CH3CH2CH=O + H2 → CH3CH2CH2OH
Tradiční laboratorní příprava 1-propanolu spočívá v reakci n-propyljodidu s vlhkým oxidem stříbrným.
Historie
[editovat | editovat zdroj]1-propanol byl objeven Chancelem v roce 1853 při frakční destilaci přiboudliny.
Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku Propan-1-ol na anglické Wikipedii.
- ↑ a b Propanol. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- Handbook of Chemistry and Physics, 71st edition, CRC Press, Ann Arbor, Michigan, 1990.
- The Merck Index, 7th edition, Merck & Co, Rahway, New Jersey, USA, 1960.
- Perkin, W. H.; Kipping, F. S. (1922). Organic Chemistry, London: W. & R. Chambers.
Externí odkazy
[editovat | editovat zdroj] Obrázky, zvuky či videa k tématu 1-propanol na Wikimedia Commons
Obrázky, zvuky či videa k tématu 1-propanol na Wikimedia Commons - International Chemical Safety Card 0553
- NIOSH Pocket Guide to Chemical Hazards