Propen
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Propen | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C3H6 | |||||||||||||||
| Kurzbeschreibung |
farbloses, geruchloses Gas[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 42,08 g·mol−1 | |||||||||||||||
| Aggregatzustand |
gasförmig | |||||||||||||||
| Dichte |
1,91 kg·m−3 (0 °C, 1013 hPa) | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
−47,7 °C[1] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit |
schwach löslich in Wasser (384 mg·l−1, 20 °C, 0,1 MPa)[1] | |||||||||||||||
| Dipolmoment | ||||||||||||||||
| Brechungsindex |
1,3567 (−70 °C)[3] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| MAK |
Schweiz: 10000 ml·m−3 bzw. 17500 mg·m−3[5] | |||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||
| ΔHf0 |
20,0 kJ/mol[6] | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Propen [] (Propylen []) ist ein farbloses brennbares Gas. Es wird durch thermische Spaltung (Steamcracken) der bei der Erdölverarbeitung anfallenden Leichtbenzine erhalten.
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Steamcracking
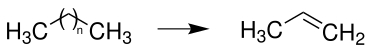
[Bearbeiten | Quelltext bearbeiten]Propen wird vorwiegend durch Steamcracken von längerkettigen Alkanen (C5-C10) synthetisiert:
Propan-Dehydrierung (PDH)
[Bearbeiten | Quelltext bearbeiten]Alternativ kann Propen durch thermisch-katalytische Behandlung von Propan unter Wasserstoffabspaltung dargestellt werden:

Dieses Verfahren wird unter anderem von BASF Sonatrach in Tarragona angewandt.[7]
Der wichtigste Prozess der Propan-Dehydrierung ist der Oleflex-Prozess von UOP, auf dem 55 % der weltweiten Kapazität basiert.[8] Bei ihm wird ein propanhaltiges Gas auf 600–700 °C vorgeheizt und in einem Fließbett-Dehydrierreaktor an einem Platin-Katalysator mit Aluminiumoxid als Träger dehydriert.[9]
Weitere Verfahren
[Bearbeiten | Quelltext bearbeiten]Propen kann außerdem per Olefinmetathese aus Ethylen und Butenen oder durch den Mobil-Prozess aus Methanol (Methanol-to-propylene) gewonnen werden.[10]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Chemische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]In Wasser ist Propen nur schwach löslich; das Gas ist brennbar. Aufgrund seiner Doppelbindung ist Propen ein ungesättigter Kohlenwasserstoff und neigt deshalb zu Additionsreaktionen, unter anderem mit Wasserstoff und Halogenen.
Beispiele:
Propen reagiert mit Brom zu 1,2-Dibrompropan:

Propen reagiert mit Wasserstoff zu Propan:

Damit die Additionsreaktion ablaufen kann, werden z. B. Platin- oder Palladiumkatalysatoren verwendet.
Bei der (säurekatalysierten) Addition von Wasser entsteht 2-Propanol:

Hexafluorpropen ist die vollständig fluorierte Form des Propens.
Durch Polymerisation von Propen entsteht der weitverbreitete thermoplastische Kunststoff Polypropylen.
Sicherheitstechnische Kenngrößen
[Bearbeiten | Quelltext bearbeiten]Propen bildet mit Luft leicht entzündliche Gemische. Der Explosionsbereich liegt zwischen 1,8 Vol.‑% (32 g/m3) als untere Explosionsgrenze (UEG) und 11,2 Vol.‑% (200 g/m3) als obere Explosionsgrenze (OEG).)[1][11] Der maximale Explosionsdruck beträgt 9,4 bar.[1] Die Grenzspaltweite wurde mit 0,91 mm bestimmt.[1][11] Es resultiert damit eine Zuordnung in die Explosionsgruppe IIA.[11] Die Zündtemperatur beträgt 485 °C.[1][11] Der Stoff fällt somit in die Temperaturklasse T1.
Verwendung
[Bearbeiten | Quelltext bearbeiten]Propen wird als Gas für das Brennschneiden und Ähnliches verwendet und ist ein Kältemittel in industriellen Kälteanlagen (R-1270). Weiterhin ist es einer der wichtigsten Grundstoffe der chemischen Industrie und dient zur Herstellung von Folgeprodukten wie zum Beispiel:
- Aceton
- Acrolein (Propenal)
- Acrylnitril
- Acrylsäure
- Allylverbindungen
- Butanal
- 1-Butanol
- Polypropylen
- Propylenoxid
- 1,2-Propandiol, 1,3-Propandiol
- Thymol
Ungefähr zwei Drittel des Propens werden für die Herstellung von Polypropylen verwendet. Die nächstgrößten Einsatzgebiete sind die Herstellung von Acrylnitril, das vorwiegend für die Fabrikation von Acryl-Textilfasern verwendet wird, und Propylenoxid, als Rohstoff für Produkte wie Polyurethan, Lacke und Klebstoffe, Polyesterharze, Kühl-, Frostschutz- und Lösungsmittel gebraucht werden. Rund 5 Prozent des Propens werden zur Herstellung von Phenol und Aceton im Cumolhydroperoxid-Verfahren eingesetzt.[12]
Sicherheitshinweise
[Bearbeiten | Quelltext bearbeiten]Propen ist wenig giftig, wirkt aber bei hoher Konzentration narkotisierend und erstickend. Da Propen eine größere Dichte als Luft hat und brennbar ist, bilden sich mit Luft leicht explosionsfähige Gemische, indem sich das Propen in Bodennähe ansammelt.
Unfälle mit Propen
[Bearbeiten | Quelltext bearbeiten]Beim Tanklastzugunglück von Los Alfaques platzte am 11. Juli 1978 der mit 23 Tonnen Propen beladene Tank eines Tankwagens südlich von Sant Carles de la Ràpita (Provinz Tarragona, Spanien). Das Propen ergoss sich über den benachbarten Campingplatz Los Alfaques und entzündete sich dort. Bei diesem Unfall wurden 217 Menschen getötet und über 300 zum Teil schwer verletzt.
In Düsseldorf ist am 2. Juli 2013 ein Gütertankwagen mit Propen-Gas entgleist. Eine Explosion konnte verhindert werden. Tote und Verletzte gab es nicht.[13]
Beim Eisenbahnunfall von Hitrino in Bulgarien entgleiste und explodierte am 10. Dezember 2016 ein mit verflüssigtem Propen beladener Güterzug, wobei mehrere Menschen starben und Dutzende Gebäude zerstört wurden.[14]
Weblinks
[Bearbeiten | Quelltext bearbeiten]Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f g h i j k l m n Eintrag zu Propen in der GESTIS-Stoffdatenbank des IFA, abgerufen am 27. Juli 2017. (JavaScript erforderlich)
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Permittivity (Dielectric Constant) of Gases, S. 6-188.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-442.
- ↑ Eintrag zu Propene im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 115-07-1 bzw. Propen), abgerufen am 2. November 2015.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-24.
- ↑ BASF Sonatrach PropanChem
- ↑ UOP Light Olefin Solutions for Propylene and Ethylene Production.
- ↑ Patent EP1824803B1: Verfahren zur Herstellung von Propen aus Propan. Angemeldet am 8. Dezember 2005, veröffentlicht am 10. Juni 2009, Anmelder: BASF, Erfinder: Götz-Peter Schindler, Sven Crone, Otto Machhammer.
- ↑ Jeffrey S. Plotkin: The Propylene Gap: How Can It Be Filled? 14. September 2015.
- ↑ a b c d E. Brandes, W. Möller: Sicherheitstechnische Kenngrößen. Band 1: Brennbare Flüssigkeiten und Gase. Wirtschaftsverlag NW – Verlag für neue Wissenschaft, Bremerhaven 2003.
- ↑ Ceresana Research: Marktstudie Propylen, Januar 2011.
- ↑ rp-online.de: Kesselwaggon in Düsseldorf entgleist: Gefahrgut-Unfall legt Bahnverkehr lahm ( vom 5. Juli 2013 im Internet Archive), 2. Juli 2013.
- ↑ theguardian.com: Several killed as Bulgarian freight train derails and explodes, abgerufen am 11. Dezember 2016.

