0 calificaciones0% encontró este documento útil (0 votos)
1K vistasCalor Integral de Disolución
Calor Integral de Disolución
Cargado por
jhenfer123El calor integral de disolución es la variación de entalpía que ocurre cuando se disuelve una cantidad de soluto en un disolvente. Depende de factores como la temperatura, presión, y número de moles de soluto y disolvente. El calor integral de solución mide el cambio de entalpía cuando 1 mol de soluto se mezcla con una cantidad fija de disolvente puro, mientras que el calor integral de dilución mide el cambio cuando 1 mol de soluto se diluye entre más disolvente a concentraciones diferentes.
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como DOCX, PDF, TXT o lea en línea desde Scribd
Calor Integral de Disolución
Calor Integral de Disolución
Cargado por
jhenfer1230 calificaciones0% encontró este documento útil (0 votos)
1K vistas2 páginasEl calor integral de disolución es la variación de entalpía que ocurre cuando se disuelve una cantidad de soluto en un disolvente. Depende de factores como la temperatura, presión, y número de moles de soluto y disolvente. El calor integral de solución mide el cambio de entalpía cuando 1 mol de soluto se mezcla con una cantidad fija de disolvente puro, mientras que el calor integral de dilución mide el cambio cuando 1 mol de soluto se diluye entre más disolvente a concentraciones diferentes.
Descripción original:
=)
Derechos de autor
© © All Rights Reserved
Formatos disponibles
DOCX, PDF, TXT o lea en línea desde Scribd
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
El calor integral de disolución es la variación de entalpía que ocurre cuando se disuelve una cantidad de soluto en un disolvente. Depende de factores como la temperatura, presión, y número de moles de soluto y disolvente. El calor integral de solución mide el cambio de entalpía cuando 1 mol de soluto se mezcla con una cantidad fija de disolvente puro, mientras que el calor integral de dilución mide el cambio cuando 1 mol de soluto se diluye entre más disolvente a concentraciones diferentes.
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como DOCX, PDF, TXT o lea en línea desde Scribd
Descargar como docx, pdf o txt
0 calificaciones0% encontró este documento útil (0 votos)
1K vistas2 páginasCalor Integral de Disolución
Calor Integral de Disolución
Cargado por
jhenfer123El calor integral de disolución es la variación de entalpía que ocurre cuando se disuelve una cantidad de soluto en un disolvente. Depende de factores como la temperatura, presión, y número de moles de soluto y disolvente. El calor integral de solución mide el cambio de entalpía cuando 1 mol de soluto se mezcla con una cantidad fija de disolvente puro, mientras que el calor integral de dilución mide el cambio cuando 1 mol de soluto se diluye entre más disolvente a concentraciones diferentes.
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como DOCX, PDF, TXT o lea en línea desde Scribd
Descargar como docx, pdf o txt
Está en la página 1de 2
CALOR INTEGRAL DE DISOLUCIÓN:
Se define como la variación de entalpía que se produce al disolver una
determinada cantidad de soluto en cierta cantidad de disolvente. La variación
total de calor, por mol de soluto, cuando la disolución se ha completado, es el
calor integral de disolución.
El calor integral de disolución varía con el número de moles de disolvente en los
que se ha disuelto el soluto. Cuando el soluto se disuelve en una cantidad de
disolución tan grande que cualquier dilución adicional no da lugar a ninguna
variación de calor, se emplea el subíndice (aq) en la ecuación termoquímica.
El efecto térmico tan frecuentemente observado al mezclar ácido sulfúrico con
una gran cantidad de agua puede representarse por la ecuación Se denomina
calor integral de solución al cambio de entalpía, cuando 1 mol de soluto se
mezcla con una cantidad fija de solvente puro.
Entonces el calor integral de solución está relacionado con la cantidad de
solvente o corresponde a una concentración determinada.
Sin embargo, es más interesante conocer la cantidad de calor absorbida o
desprendida por mol de sustancia en el proceso completo, es decir, cuando se
disuelve toda la sustancia en la cantidad de disolvente elegido. A la cantidad de
calor generada en estas condiciones viene dado por:
𝑛
𝜕(∆𝐻)
∆𝐻 = {∫ } 𝑑𝑇
0 𝜕𝑛
Se debe diferenciar el calor integral de solución de calor integral de dilución (este
último es la variación de entalpía de solución cuando 1 mol de soluto se diluye
con el mismo solvente puro de una concentración a otra y es igual a la diferencia
de calores integrales de cada una de las concentraciones.
En el límite cuando la fracción molar del solvente tiende a 1 se tiene el calor
integral del soluto a dilución infinita (∆Hintα) y es igual al calor absorbido por el
sistema cuando un mol de soluto se disuelve en una cantidad infinita de solvente
a T y P constantes.
Experimentalmente se observa que la entalpía integral de solución ∆Hint
depende de
T, P n1y n2 (para una mezcla de dos componentes: un soluto y el solvente); esto
es:
∆Hint= ∆Hint (T, P, n1, n2)
La diferencia total de (1) es:
𝜕(∆𝐻𝑖𝑛𝑡 ) 𝜕(∆Hint ) 𝜕(∆𝐻𝑖𝑛𝑡 ) 𝜕(∆𝐻𝑖𝑛𝑡 )
d∆Hint = ( )𝑑𝑇 + ( )𝑑𝑃 +( )𝑑n1+( )𝑑n2
𝜕𝑇 𝜕𝑃 𝜕𝑛1 𝜕𝑛2
Donde:
𝜕(∆𝐻𝑖𝑛𝑡) 𝜕(∆𝐻𝑖𝑛𝑡)
∆H1 = ( )∆H2 = ( )
𝜕𝑛1 𝜕𝑛2
En la termodinámica se demuestra que la ecuación es equivalente a:
∆Hint = ∆H1n1 + ∆H2n2
∆H1 y ∆H2 son los calores diferenciales o las entalpías molares parciales de
solución del soluto y solvente respectivamente y son funciones de T, P y la
composición de la solución.
El calor diferencial de solución implica una situación en la que se mide el
incremento de entalpía cuando un mol de solvente o de soluto se disuelve en un
volumen tan grande de solución que no se aprecia cambio apreciable en la
concentración de esta.
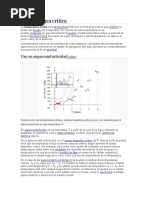
Una curva característica que representa la variación del calor integral de 1 mol
de soluto (n2= 1 = cte.) en solvente (n1).
CALORES DE SOLUCION DE ALGUNOS COMPUESTOS
Compuestos ΔH° en kJ/mol en agua
Cloruro de hidrogeno -17.9
Nitrato de amonio + 6.14
Hidróxido de potasio -13.77
Hidróxido de cesio -17.10
Cloruro de sodio + 3.89
Clorato de potasio + 9.89
Ácido acético -0.360
También podría gustarte
- Interfase Liquido - GasDocumento40 páginasInterfase Liquido - GasJhon AyalaAún no hay calificaciones
- Ecuación de AntoineDocumento5 páginasEcuación de AntoineHector Arias100% (2)
- Práctica 1: Determinación de La Entalpía de Descomposición Del Peróxido de HidrogenoDocumento6 páginasPráctica 1: Determinación de La Entalpía de Descomposición Del Peróxido de HidrogenoGiselleLorenaFlorezLopezAún no hay calificaciones
- Sesión 02 Soluciones Ideales y RealesDocumento69 páginasSesión 02 Soluciones Ideales y RealesRENATO JAIR COSTA MINGAAún no hay calificaciones
- Tabla Nu - GSDocumento1 páginaTabla Nu - GSAnaid Dayana Galina GarciaAún no hay calificaciones
- Tema I. Produccion de MetanolDocumento45 páginasTema I. Produccion de MetanolMiguel Reynaldo CabreraAún no hay calificaciones
- Calor de Combustión Del Ácido Benzoico.Documento5 páginasCalor de Combustión Del Ácido Benzoico.Elvis CoronelAún no hay calificaciones
- Practica 6 Peso Molecular Por Metodo de RastDocumento6 páginasPractica 6 Peso Molecular Por Metodo de RastJavier RG100% (2)
- Fisicoquimica Cap 10Documento5 páginasFisicoquimica Cap 10Andrea VieraAún no hay calificaciones
- TermoDocumento18 páginasTermoISRAELAún no hay calificaciones
- Beta MetoxinaftalenoDocumento11 páginasBeta MetoxinaftalenoAreli CastilloAún no hay calificaciones
- Proyecto de Simulación Aspen Hysys Licuefaccion 2023Documento29 páginasProyecto de Simulación Aspen Hysys Licuefaccion 2023Andelie GarciaAún no hay calificaciones
- 11 Produccion de Acido NitricoDocumento24 páginas11 Produccion de Acido NitricoAlejaGCaica100% (1)
- Modelo Cinético para Reacciones No ElementalesDocumento2 páginasModelo Cinético para Reacciones No ElementalesJessica CampaaAún no hay calificaciones
- Avance - Producción de ButiraldehidoDocumento9 páginasAvance - Producción de ButiraldehidoLuisMPortillaBenavidesAún no hay calificaciones
- Determinación Del DabDocumento29 páginasDeterminación Del DabcproyectAún no hay calificaciones
- Práctica 3 - Equilibrio Líquido Vapor - FINALDocumento7 páginasPráctica 3 - Equilibrio Líquido Vapor - FINALAlejandra Rosero BastidasAún no hay calificaciones
- ISOMERIZACIONDocumento53 páginasISOMERIZACIONhipnofenix50% (2)
- Determinación de La Constante de Henry de CO2 en AguaDocumento2 páginasDeterminación de La Constante de Henry de CO2 en AguaLaura RodríguezAún no hay calificaciones
- Practica 2, AbsorcionDocumento12 páginasPractica 2, AbsorcionfatimaAún no hay calificaciones
- ISOMERIZACIONDocumento21 páginasISOMERIZACIONjroals0976% (21)
- Presentacion ASTM D 524Documento10 páginasPresentacion ASTM D 524srredasAún no hay calificaciones
- Destilacion de Liquidos Parcialmente MisciblesDocumento2 páginasDestilacion de Liquidos Parcialmente MisciblesElizabeth RamosAún no hay calificaciones
- Absorcion Por Aceite LigeroDocumento34 páginasAbsorcion Por Aceite LigeroRobertoCarlosDazaAún no hay calificaciones
- Diseño para Reacciones MúltiplesDocumento6 páginasDiseño para Reacciones MúltiplesFRANS ROMOAún no hay calificaciones
- Temperatura CríticaDocumento2 páginasTemperatura CríticaSaul PjAún no hay calificaciones
- CUESTIONARIO de CristalizacionDocumento4 páginasCUESTIONARIO de CristalizacionDante100% (1)
- Resumen Capitulo 15 CastellanDocumento30 páginasResumen Capitulo 15 CastellanAlejandro Garcia GarciaAún no hay calificaciones
- Practica No 1 Propiedades Molares ParcialesDocumento11 páginasPractica No 1 Propiedades Molares ParcialesArturo Dominguez AdriaoAún no hay calificaciones
- Actividad y Selectividad Catalitica 1Documento13 páginasActividad y Selectividad Catalitica 1Roxana Maribel Cordero FloresAún no hay calificaciones
- HidrocraqueoDocumento3 páginasHidrocraqueoOrianaDoriaAún no hay calificaciones
- 73534-8464-Proyecto TransversalDocumento11 páginas73534-8464-Proyecto TransversalJenniAún no hay calificaciones
- Diseño Reactor Lecho FluidizadoDocumento22 páginasDiseño Reactor Lecho FluidizadoEdison Hiroshi Apaclla HuereAún no hay calificaciones
- Calor DisoluciónDocumento32 páginasCalor DisoluciónStrokes LemusAún no hay calificaciones
- Propiedades Molares ParcialesDocumento9 páginasPropiedades Molares ParcialesAnonymous Sk29MhtAún no hay calificaciones
- Practica 1 LTP 7mo Estudio de Un Sistema de Tres Componentes en EquilibrioDocumento9 páginasPractica 1 LTP 7mo Estudio de Un Sistema de Tres Componentes en EquilibrioFernanda VinyardAún no hay calificaciones
- Analisis CualitativoDocumento15 páginasAnalisis CualitativoNATALY ERIKA CABEZAS AGUILARAún no hay calificaciones
- Fugacidad y Cálculo de Fugacidad de Un Líquido PuroDocumento62 páginasFugacidad y Cálculo de Fugacidad de Un Líquido PuroAldo Agustín Fonseca PérezAún no hay calificaciones
- Diagrama de Punto de Ebullicion MezclaDocumento10 páginasDiagrama de Punto de Ebullicion MezclaGilvert J Vasquez MendozaAún no hay calificaciones
- Practica de ExtraccionDocumento26 páginasPractica de ExtraccionJacqueline Velázquez JuarezAún no hay calificaciones
- Unidad II Selección de Solventes para Absorción FísicaDocumento14 páginasUnidad II Selección de Solventes para Absorción FísicaNERIO ANTONIO STRUVE ROMEROAún no hay calificaciones
- Métodos de Preparación de Catalizadores SólidosDocumento37 páginasMétodos de Preparación de Catalizadores SólidosEDWIN ALEXIS MONTILLA UZC�TEGUIAún no hay calificaciones
- Métodos de Preparación Catalizadores 1Documento10 páginasMétodos de Preparación Catalizadores 1Tzitzi Alvarez MendozaAún no hay calificaciones
- Coeficiente de ActividadDocumento2 páginasCoeficiente de ActividadMontse CruzAún no hay calificaciones
- Ejercicio 8.12Documento14 páginasEjercicio 8.12Fabián Flores GuamánAún no hay calificaciones
- Monografia Metodo WinklerDocumento12 páginasMonografia Metodo WinklerVíctor FurbinoAún no hay calificaciones
- DFP Acido SulfuricoDocumento24 páginasDFP Acido SulfuricoKimberly AndradeAún no hay calificaciones
- Practica 2 Termo FinalDocumento12 páginasPractica 2 Termo FinalAnonymous jU0TwwIAún no hay calificaciones
- Ecuación de AntoineDocumento3 páginasEcuación de AntoineJosé Luis Soto AlcocerAún no hay calificaciones
- Trabajo Unidad IIDocumento2 páginasTrabajo Unidad IIJuan MartínezAún no hay calificaciones
- Metodo Grafico de WinkelmannDocumento4 páginasMetodo Grafico de WinkelmannCarmen HernandezAún no hay calificaciones
- Parcial RXDocumento1 páginaParcial RXatahualpa martinez100% (1)
- Informe 2 Destilación FraccionadaDocumento14 páginasInforme 2 Destilación Fraccionadajairo guerreroAún no hay calificaciones
- Produccion de BencenoDocumento1 páginaProduccion de BencenoEnrique SoriaAún no hay calificaciones
- Exposicion Final de CineticaDocumento43 páginasExposicion Final de CineticaJesusGum100% (1)
- Principios Generales de La Lixiviación 1Documento4 páginasPrincipios Generales de La Lixiviación 1eulaquioAún no hay calificaciones
- 03 Calor de NeutralizacionDocumento17 páginas03 Calor de NeutralizacionWeymar Eddy Mamani QuispeAún no hay calificaciones
- CLASE2 Soluciones IDocumento41 páginasCLASE2 Soluciones ISara EstherAún no hay calificaciones
- Ingeniería química. Soluciones a los problemas del tomo IDe EverandIngeniería química. Soluciones a los problemas del tomo IAún no hay calificaciones
- Practica Calificada Maquinas y Equipos en Ingenieria Sanitaria 2019Documento2 páginasPractica Calificada Maquinas y Equipos en Ingenieria Sanitaria 2019jhenfer123Aún no hay calificaciones
- Plan de Proyeccion SocialDocumento6 páginasPlan de Proyeccion Socialjhenfer123Aún no hay calificaciones
- Practica Calificada A Maquinas y Equipos en Ingenieria Sanitaria 2019 PDFDocumento2 páginasPractica Calificada A Maquinas y Equipos en Ingenieria Sanitaria 2019 PDFjhenfer123Aún no hay calificaciones
- INSTRUCTIVO Ficha Técnica de PI Estandar y Simplificada Servicio Limpieza PúblicaDocumento5 páginasINSTRUCTIVO Ficha Técnica de PI Estandar y Simplificada Servicio Limpieza Públicajhenfer123Aún no hay calificaciones
- Mesapata 1Documento26 páginasMesapata 1jhenfer123Aún no hay calificaciones
- Municalidad Distrital de Huacachi San Martin de MaraDocumento9 páginasMunicalidad Distrital de Huacachi San Martin de Marajhenfer123Aún no hay calificaciones
- Clase de Operaciones UnitariasDocumento63 páginasClase de Operaciones Unitariasjhenfer123Aún no hay calificaciones
- Tuberias, Valvulas y AccesoriosDocumento48 páginasTuberias, Valvulas y Accesoriosjhenfer123Aún no hay calificaciones
- Operaciones UnitariasDocumento18 páginasOperaciones Unitariasjhenfer123Aún no hay calificaciones
- Informe PTAR CarhuazDocumento11 páginasInforme PTAR Carhuazjhenfer123Aún no hay calificaciones
- Saneamiento Basico Agua PotableDocumento15 páginasSaneamiento Basico Agua Potablejhenfer123Aún no hay calificaciones
- Caseta CLoracion CHUMBOLDocumento1 páginaCaseta CLoracion CHUMBOLjhenfer123Aún no hay calificaciones
- Soluciones Actividades 3o Eso Tema 2Documento12 páginasSoluciones Actividades 3o Eso Tema 2Andreii15Aún no hay calificaciones
- Braskem HP 648sDocumento1 páginaBraskem HP 648sCesar VillegasAún no hay calificaciones
- Bebida de ColaDocumento16 páginasBebida de ColaJambo Cueva BitelloAún no hay calificaciones
- MANUAL TNA 3 MB-PB238-1-0 - InstructivoDocumento4 páginasMANUAL TNA 3 MB-PB238-1-0 - InstructivojanAún no hay calificaciones
- Historia Del ChocolateDocumento4 páginasHistoria Del ChocolateAndrea Elizabeth ArmijosAún no hay calificaciones
- Equilibrio Ionico Del AguaDocumento2 páginasEquilibrio Ionico Del AguaJhosuny Pérez FernándezAún no hay calificaciones
- Catálogo Verano - ZaikaDocumento33 páginasCatálogo Verano - ZaikaKatherine Jiménez de AguilarAún no hay calificaciones
- 6 Valoracion de La OxigenaciÓn y Transporte Del OxigenoDocumento8 páginas6 Valoracion de La OxigenaciÓn y Transporte Del Oxigenoapi-3697492100% (1)
- Irrigantes en EndodonciaDocumento25 páginasIrrigantes en EndodonciaandresAún no hay calificaciones
- Diseño TuberiaDocumento14 páginasDiseño TuberiaJuan Fernando Arestegui HuillcaAún no hay calificaciones
- Análisis Fisicoquímicos de Grasas y AceitesDocumento15 páginasAnálisis Fisicoquímicos de Grasas y AceitesLisette Becerra90% (10)
- Borrador NORMA NSR 10Documento13 páginasBorrador NORMA NSR 10leonarcoyAún no hay calificaciones
- Guia de Electroforesis para Proteinas 2Documento9 páginasGuia de Electroforesis para Proteinas 2Julieth Stefania Cano ManjarresAún no hay calificaciones
- 2014-10 Dosificación de Hormigón Con Cemento Holcim FuerteDocumento44 páginas2014-10 Dosificación de Hormigón Con Cemento Holcim FuerteJefferson O. Duchi Guaman100% (7)
- CuestionarioDocumento2 páginasCuestionariopancholopezmartinez611Aún no hay calificaciones
- Protocolo Prueba de BombeoDocumento12 páginasProtocolo Prueba de BombeoGrover Mealla100% (1)
- Limites Microbiologicos Rev. 2012 MipromaDocumento2 páginasLimites Microbiologicos Rev. 2012 Mipromalin13230% (1)
- Riesgos Debidos A La Electricidad EstaticaDocumento99 páginasRiesgos Debidos A La Electricidad EstaticavitzarisAún no hay calificaciones
- Informe de Abono Organico Sangre de BovinoDocumento13 páginasInforme de Abono Organico Sangre de BovinoKevin GarciaAún no hay calificaciones
- Ecografia de Los Materiales de RellenoDocumento9 páginasEcografia de Los Materiales de RellenoOmarAún no hay calificaciones
- Trabajo Práctico Nº1 QobDocumento6 páginasTrabajo Práctico Nº1 QobMiyer RiveroAún no hay calificaciones
- Guia de Alcoholes y FenolesDocumento3 páginasGuia de Alcoholes y FenolesPaulo Alejandro Araos Brito100% (1)
- Aminas II 2016Documento32 páginasAminas II 2016Andrea Avila HernándezAún no hay calificaciones
- Eett-Electromecanicas PiuraDocumento157 páginasEett-Electromecanicas PiuraDickson FacundoAún no hay calificaciones
- La Historia de Lagunillas Estado ZuliaDocumento4 páginasLa Historia de Lagunillas Estado ZuliaJoselin Vásquez ChAún no hay calificaciones
- Perdidas Menores o Por AccesoriosDocumento13 páginasPerdidas Menores o Por AccesoriosAtziri Esau Carreon OchoaAún no hay calificaciones
- Todo Lo Bueno de La Marihuana Sin Nada de Lo MaloDocumento8 páginasTodo Lo Bueno de La Marihuana Sin Nada de Lo MaloRITA CAMPILLO FERRERAún no hay calificaciones
- Tema 3 Preparados o Formas F.Documento6 páginasTema 3 Preparados o Formas F.Araceli PoloAún no hay calificaciones
- Resumen Novela Soldadito de PlomoDocumento10 páginasResumen Novela Soldadito de PlomoCalero Renato0% (1)
- Procesamiento de Plumas de Pollo para La Obtención de QueratinaDocumento2 páginasProcesamiento de Plumas de Pollo para La Obtención de QueratinaBrittNiveloAún no hay calificaciones