Elaboración de Informes Con El Formato de Artículo Científico
Elaboración de Informes Con El Formato de Artículo Científico
Cargado por
ksteverlynckfrutosCopyright:
Formatos disponibles
Elaboración de Informes Con El Formato de Artículo Científico
Elaboración de Informes Con El Formato de Artículo Científico
Cargado por
ksteverlynckfrutosTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Copyright:
Formatos disponibles
Elaboración de Informes Con El Formato de Artículo Científico
Elaboración de Informes Con El Formato de Artículo Científico
Cargado por
ksteverlynckfrutosCopyright:
Formatos disponibles
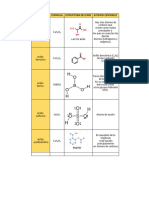
Exploración de Moléculas y Enlaces Químicos:
Construcción y Visualización con un Kit Molecular
Autores
Kiara Steverlynck Frutos a
Facultad de Ciencias Básica, Universidad Católica Boliviana, La Paz, Bolivia. b Laboratorio de
Química General II, La Paz.
steverlycnkkiara@gmail.com
Resumen
Da una visión de conjunto del trabajo e informa brevemente de todas sus secciones, incluyendo
resultados y conclusiones. Puede estar estructurado, con los apartados de antecedentes
(background), métodos, resultados y conclusiones, o no estructurado, con la información
organizada en dos o tres párrafos.
Abstract
Es el mismo contenido que se tiene en el resumen pero en el idioma inglés.
Palabras clave o Key words
Key words: Extracción (nos indica la técnica utilizada), Organoléptico (indica la propiedad que
puede percibirse con los sentidos), Inmiscible (propiedad de los líquidos).
Introducción capacidad para compartir o transferir
electrones (Chang, 2016).
Una molécula es la unidad más pequeña de
una sustancia química que conserva las Los enlaces químicos que forman las
propiedades de esa sustancia. Está formada moléculas se clasifican principalmente en
por dos o más átomos que se mantienen iónicos, covalentes y metálicos. En los enlaces
unidos mediante enlaces químicos. Las covalentes, los átomos comparten electrones
moléculas pueden estar compuestas por para completar sus capas de valencia,
átomos del mismo elemento, como el mientras que, en los enlaces iónicos, un
oxígeno (O2), o por átomos de diferentes átomo transfiere uno o más electrones a otro,
elementos, como el agua (H2O). Las generando una atracción electrostática entre
moléculas son fundamentales en la química, ellos. Los enlaces metálicos, por otro lado, se
ya que forman la base de las reacciones caracterizan por la presencia de una "nube de
químicas y determinan las propiedades de la electrones" que fluye libremente entre los
materia. La estabilidad de una molécula átomos metálicos, otorgando propiedades
depende de la fuerza de los enlaces entre los únicas como la conductividad. Además, la
átomos que la componen, que pueden ser naturaleza de los enlaces, como su longitud,
iónicos, covalentes o metálicos, según la fuerza y polaridad, influye en la estabilidad y
naturaleza de los átomos involucrados y su propiedades de la molécula (Atkins & de
Paula, 2002). solitarios y compartidos (Zumdahl &
Zumdahl, 2010).
La polaridad de las moléculas se puede
determinar a partir de la diferencia de En cuanto a los ángulos de enlace, estos se
electronegatividad entre los átomos; si esta definen como el ángulo formado entre dos
diferencia es significativa, la molécula será enlaces adyacentes de un átomo central. La
polar, lo que influye en sus propiedades geometría molecular y los ángulos de enlace
físicas y químicas, como la solubilidad y la están directamente relacionados, ya que
interacción con otras moléculas (Chang, moléculas con geometría lineal, como el
2016). dióxido de carbono (CO2) tienen ángulos de
180°, mientras que las moléculas con
La geometría molecular se refiere a la geometría tetraédrica, como el metano (CH 4),
disposición tridimensional de los átomos presentan ángulos de aproximadamente
dentro de una molécula, influenciada 109.5°. Estos ángulos varían dependiendo de
principalmente por el tipo de enlace que une la naturaleza de los enlaces y la repulsión
los átomos y la cantidad de pares de entre pares electrónicos, siguiendo el modelo
electrones alrededor del átomo central. de VSEPR (Chang, 2016; Atkins, 2002).
Según la Teoría de Repulsión de Pares de
Electrones de la Capa de Valencia (VSEPR), La clasificación de las moléculas se basa en su
los pares de electrones, tanto enlazantes geometría y en la distribución de los átomos.
como no enlazantes, tienden a repelerse y Existen moléculas lineales, como el dióxido
organizarse en el espacio lo más alejados de carbono (CO2) trigonal planar, como el
posible entre sí, determinando la geometría tricloruro de boro (BF3), y tetraédricas, como
molecular. Por ejemplo, el agua (H2O) el metano (CH4). La geometría de una
presenta una geometría angular debido a los molécula está determinada por la repulsión
pares de electrones no enlazantes sobre el entre los pares de electrones enlazantes y no
átomo de oxígeno que generan una repulsión enlazantes, según la Teoría de Repulsión de
más intensa, afectando los ángulos de enlace Pares de Electrones de la Capa de Valencia
(Chang, 2016). (VSEPR). Además, las moléculas se pueden
clasificar según su complejidad, como
La Ley de Lewis, desarrollada por Gilbert N. moléculas simples (diatómicas o triatómicas)
Lewis, permite representar las moléculas y moléculas complejas (biomoléculas o
mediante estructuras de puntos que ilustran polímeros). La simetría y polaridad de las
los electrones de valencia involucrados en la moléculas influye en sus propiedades físicas,
formación de enlaces. En las estructuras de como la solubilidad y el punto de ebullición, y
Lewis, los enlaces covalentes se representan también en su reactividad química (Chang,
como líneas entre átomos, donde cada línea 2016).
indica la compartición de un par de
electrones. Esta representación es útil para
identificar posibles formas de enlaces Material y Métodos
sencillos, dobles o triples, según la cantidad Se comenzó con pintar las esferas de plastoformo. El
de electrones compartidos. Las estructuras color rojo se utilizará para la esfera que representa el
de Lewis también permiten predecir la oxígeno, el negro para las esferas que representan los
geometría molecular al identificar pares átomos de carbono, y el blanco para las esferas que
representan los átomos de hidrógeno. Las esferas se
dejaron secar completamente antes de proceder.
Mientras las esferas secaban se comenzó con el corte
de los palillos de brocheta en diferentes longitudes.
Los enlaces entre los átomos de carbono y oxígeno
deberán ser ligeramente más largos que aquellos
entre los hidrógenos y los carbonos.
Aproximadamente, se necesitarán cinco trozos de
palillos: dos para los enlaces entre los átomos de
carbono y oxígeno, y tres más cortos para los enlaces
con los hidrógenos.
Para ensamblar la estructura se insertó un palillo de
brocheta entre las dos esferas negras (que
representan los átomos de carbono) para formar el
esqueleto de la molécula. Luego, se añadió la esfera
roja (oxígeno) a uno de los carbonos usando otro
palillo de brocheta. Posteriormente se insertaron las
tres esferas blancas (hidrógenos) alrededor de los
carbonos utilizando los trozos más cortos de los
palillos. Cada carbono se unió a un hidrógeno.
Se ajustaron los ángulos de los enlaces a la disposición
correcta de los átomos, asegurándose de que la
maqueta refleje la geometría tridimensional del ácido
láctico. Los átomos deben estar dispuestos en un
arreglo que simule los ángulos de enlace, similar a la
estructura tetraédrica de los átomos de carbono
aproximadamente 109.5° entre los enlaces covalentes.
Resultados
Discusión
Esta sección es el corazón del manuscrito, en
ella se comentan, interpretan, valoran y
contextualizan los resultados, en relación a
los objetivos e hipótesis planteados.
Se explican los hallazgos alcanzados en
relación al conocimiento actual sobre el tema
de estudio.
Referencias o bibliografía
Atkins, P., & de Paula, J. (2002). Physical
Chemistry (7th ed.). Oxford University Press.
Chang, R. (2016). Química (12a ed.). McGraw-
Hill.
Zumdahl, S. S., & Zumdahl, S. A. (2010).
Chemistry (9th ed.). Cengage Learning.
También podría gustarte
- Folleto Quimica General I ESPOL PDFDocumento91 páginasFolleto Quimica General I ESPOL PDFPatoCepedaAún no hay calificaciones
- DurasparkDocumento35 páginasDurasparkLaureano Abraham Chi Rodriguez100% (2)
- Tarea 2.1Documento5 páginasTarea 2.1Billaine Ciprian.Aún no hay calificaciones
- Consulta N°2 Quimica General 1. Angamarca Angulo Brayan Alexander.Documento10 páginasConsulta N°2 Quimica General 1. Angamarca Angulo Brayan Alexander.BryanAngamarcaAún no hay calificaciones
- Fisica 2Documento6 páginasFisica 2jperez55-esAún no hay calificaciones
- Proyecto QuimicaDocumento32 páginasProyecto Quimicayr7269656Aún no hay calificaciones
- CONCLUSIONE Organica Informe 7Documento4 páginasCONCLUSIONE Organica Informe 7jhamer rivera nuñezAún no hay calificaciones
- Informe Unidad 3Documento25 páginasInforme Unidad 3sofmtnz2Aún no hay calificaciones
- Geometria Electronica QuimicaDocumento10 páginasGeometria Electronica QuimicaBryanAngamarcaAún no hay calificaciones
- Enlaces Químicos y Angulo de Enlace.Documento6 páginasEnlaces Químicos y Angulo de Enlace.Richard MonterrosaAún no hay calificaciones
- Modelo MolecularDocumento18 páginasModelo MolecularEnzo Quispe AlccaAún no hay calificaciones
- Kit MolecularDocumento5 páginasKit MolecularksteverlynckfrutosAún no hay calificaciones
- Uniones QuimicasDocumento13 páginasUniones QuimicasSheila SturnioloAún no hay calificaciones
- Portafolio de Evidencias Quimica Organica - KAOADocumento13 páginasPortafolio de Evidencias Quimica Organica - KAOAKauris OvandoAún no hay calificaciones
- 9no Grado. Ciencias 2da ClaseDocumento7 páginas9no Grado. Ciencias 2da ClaseDIEGO CONRADO VILLALBA BENITEZAún no hay calificaciones
- Quimica Ii Atomo Del Carbono InvestigacionDocumento7 páginasQuimica Ii Atomo Del Carbono InvestigacionmarianAún no hay calificaciones
- 10 - 11 - Quim - Moléculas y Compuestos (Artículo) - Khan AcademyDocumento18 páginas10 - 11 - Quim - Moléculas y Compuestos (Artículo) - Khan AcademyFabian Chacon HurtadoAún no hay calificaciones
- Guia de Quimica OrganicaDocumento16 páginasGuia de Quimica OrganicaFelix RamAún no hay calificaciones
- Tema 1Documento17 páginasTema 1jcasares888Aún no hay calificaciones
- Enlaces QuimicosDocumento9 páginasEnlaces QuimicosJose Manuel RuizAún no hay calificaciones
- Representación de Moléculas Orgánicas A Partir de LaDocumento82 páginasRepresentación de Moléculas Orgánicas A Partir de LaBrenda ValencianoAún no hay calificaciones
- R.A 2.3 Enlace QuimicoDocumento5 páginasR.A 2.3 Enlace QuimicoRoberto BelloAún no hay calificaciones
- Co ValenteDocumento13 páginasCo ValenteJaviSerewAún no hay calificaciones
- Ensayo para Que Se Unen Los AtomosDocumento6 páginasEnsayo para Que Se Unen Los AtomosALEJANDRO PEREZ HERNANDEZAún no hay calificaciones
- Tipos de EnlaceDocumento10 páginasTipos de EnlaceFaty SantosAún no hay calificaciones
- Cuestionario - Enlace QuímicoDocumento10 páginasCuestionario - Enlace QuímicoAshli HernándezAún no hay calificaciones
- Aspectos Relacionados Con La Química Del CarbonoDocumento27 páginasAspectos Relacionados Con La Química Del CarbonoJosè PèrezAún no hay calificaciones
- Modelos Moleculares - Informe 1Documento22 páginasModelos Moleculares - Informe 1Jvr Enriwell0% (3)
- Qui MicaDocumento6 páginasQui MicaVladimir NogalesAún no hay calificaciones
- Enlace CovalenteDocumento44 páginasEnlace Covalentemariana rojasAún no hay calificaciones
- Practica MoleculasDocumento7 páginasPractica Moleculasc1dssantosc21Aún no hay calificaciones
- Guia 1 Segundo ParcialDocumento18 páginasGuia 1 Segundo ParcialFany OvandoAún no hay calificaciones
- Enlace CovalenteDocumento12 páginasEnlace CovalenteMaria CarranzaAún no hay calificaciones
- Taller Química OrgánicaDocumento6 páginasTaller Química OrgánicacortesvanegascAún no hay calificaciones
- Folleto Diego MuñozDocumento136 páginasFolleto Diego MuñozRomel ToledoAún no hay calificaciones
- Estructura MolecularDocumento14 páginasEstructura MolecularJoseph Jair TellezAún no hay calificaciones
- Tema 6 - Geometría Molecular y Teorias de EnlaceDocumento43 páginasTema 6 - Geometría Molecular y Teorias de EnlaceMiguel MoreAún no hay calificaciones
- Químicaa Organica TEMA IDocumento4 páginasQuímicaa Organica TEMA I•Estella Bemón•Aún no hay calificaciones
- Enlaces MolecularesDocumento6 páginasEnlaces Molecularesarturo_lazherAún no hay calificaciones
- Clase4 1Documento11 páginasClase4 1NEMITH KAVINDI LUNA ALIAGAAún no hay calificaciones
- Informe Capítulos 1 y 2 Del Libro de John McmurryDocumento4 páginasInforme Capítulos 1 y 2 Del Libro de John McmurryPaula Marialys Ramirez ManzuetaAún no hay calificaciones
- Organic A 1 Dia Positi VasDocumento165 páginasOrganic A 1 Dia Positi VasGaby Key LunaAún no hay calificaciones
- Evaluación de QuímicaDocumento8 páginasEvaluación de QuímicaMaximiliano DelgadoAún no hay calificaciones
- Enlace CovalenteDocumento7 páginasEnlace CovalenteAbelardo VelazquezAún no hay calificaciones
- InformeDocumento4 páginasInformeValentina Sánchez G :3Aún no hay calificaciones
- Guia #4 SS CN4 MixtaDocumento5 páginasGuia #4 SS CN4 Mixtaluluca cortesAún no hay calificaciones
- Tema:: Enlaces Quimicos Concepto Y Tipos de EnlaceDocumento17 páginasTema:: Enlaces Quimicos Concepto Y Tipos de EnlaceAna Fatecha CabreraAún no hay calificaciones
- Quimica 2Documento15 páginasQuimica 2gomezgarciajoseadrianAún no hay calificaciones
- Monografia Compuestos de CoordinacionDocumento11 páginasMonografia Compuestos de CoordinacionCT Laiño Valeria AlejandraAún no hay calificaciones
- En Lace Co ValenteDocumento31 páginasEn Lace Co Valenteceo_quercusAún no hay calificaciones
- Enlaces QuímicosDocumento8 páginasEnlaces QuímicosSam MartínezAún no hay calificaciones
- Cuestionario Guia Primer Parcial Química OrgánicaDocumento5 páginasCuestionario Guia Primer Parcial Química OrgánicaKimberly NavarroAún no hay calificaciones
- 3.3 HIibridaciónDocumento7 páginas3.3 HIibridaciónAaron Mendez VasquezAún no hay calificaciones
- Trabajo 2 Estructura Atomica y Tipos de EnlacesDocumento8 páginasTrabajo 2 Estructura Atomica y Tipos de EnlacesAugusto Enrique Figueroa MeloAún no hay calificaciones
- Enlace Quimico y Sus PropiedadesDocumento3 páginasEnlace Quimico y Sus PropiedadesValeri JiménezAún no hay calificaciones
- Trabajo-Informe El Átomo La Base de Los MaterialesDocumento15 páginasTrabajo-Informe El Átomo La Base de Los Materialesjesus medinaAún no hay calificaciones
- Especie QuímicaDocumento7 páginasEspecie QuímicaChuma Chuma ArturoAún no hay calificaciones
- Faustino Flores Danna ItzelDocumento8 páginasFaustino Flores Danna ItzelDanna Itzel Faustino FloresAún no hay calificaciones
- Química - Unidad 3 - Enlaces QuímicosDocumento64 páginasQuímica - Unidad 3 - Enlaces QuímicosARELI100% (1)
- Quimica Trabajo 3Documento11 páginasQuimica Trabajo 3Nany HeddrichAún no hay calificaciones
- De la estructura atómica a la quiralidad.: Algunos conceptos de la químicaDe EverandDe la estructura atómica a la quiralidad.: Algunos conceptos de la químicaCalificación: 4.5 de 5 estrellas4.5/5 (2)
- MoleculasDocumento2 páginasMoleculasksteverlynckfrutosAún no hay calificaciones
- Lluvia de IdeasDocumento1 páginaLluvia de IdeasksteverlynckfrutosAún no hay calificaciones
- PRACTICa 9Documento6 páginasPRACTICa 9ksteverlynckfrutosAún no hay calificaciones
- Practica 11Documento5 páginasPractica 11ksteverlynckfrutosAún no hay calificaciones
- Practica de Laboratorio 9 RotacionDocumento6 páginasPractica de Laboratorio 9 RotacionksteverlynckfrutosAún no hay calificaciones
- Enlace QuimicoDocumento6 páginasEnlace QuimicoksteverlynckfrutosAún no hay calificaciones
- Elaboración de Informes Con El Formato de Artículo CientíficoDocumento4 páginasElaboración de Informes Con El Formato de Artículo CientíficoksteverlynckfrutosAún no hay calificaciones
- Kit MolecularDocumento5 páginasKit MolecularksteverlynckfrutosAún no hay calificaciones
- Lab 3Documento2 páginasLab 3ksteverlynckfrutosAún no hay calificaciones
- Plan de Seguridad DIQUEDocumento47 páginasPlan de Seguridad DIQUEyeferAún no hay calificaciones
- Telegram ZimmermannDocumento8 páginasTelegram ZimmermannKirssaCosteAún no hay calificaciones
- 1MedioTallerdehabilidades5 (Primera Parte)Documento2 páginas1MedioTallerdehabilidades5 (Primera Parte)kajdbanwjwjdb kqkjdjwkwjdjdAún no hay calificaciones
- EA1. Conceptos Básicos de Estadística - ExamenDocumento12 páginasEA1. Conceptos Básicos de Estadística - ExamenElizabeth GutiérrezAún no hay calificaciones
- CANCIONES GUATEMALTECAS Con Imagenes InebDocumento26 páginasCANCIONES GUATEMALTECAS Con Imagenes InebLuis GarciaAún no hay calificaciones
- Reología de Los FluidosDocumento4 páginasReología de Los FluidosVALERIAARGENTINA MENDOZA OLIVOAún no hay calificaciones
- Calendario Primer Pacial 23-24bDocumento10 páginasCalendario Primer Pacial 23-24bruben032210Aún no hay calificaciones
- PREF CL-VS-1201 Valparaíso Manantiales Reva PDFDocumento56 páginasPREF CL-VS-1201 Valparaíso Manantiales Reva PDFSantanderHomePropiedadesAún no hay calificaciones
- AV - 30 - Síndrome de Cushing o HiperadrenocorticismoDocumento3 páginasAV - 30 - Síndrome de Cushing o HiperadrenocorticismoAxoncomunicacion100% (1)
- Simulasion NitrogenoDocumento2 páginasSimulasion NitrogenoHector GuijosaAún no hay calificaciones
- La BiosemióticaDocumento2 páginasLa BiosemióticaMarcoAún no hay calificaciones
- Conductividad TermicaDocumento3 páginasConductividad TermicaRicAún no hay calificaciones
- Español - Tarea 1Documento7 páginasEspañol - Tarea 1Keyris VásquezAún no hay calificaciones
- Medidas y Factores de ConversionDocumento33 páginasMedidas y Factores de Conversionjoanna de LeónAún no hay calificaciones
- Sesion Corrientes LibertadorasDocumento10 páginasSesion Corrientes LibertadorasMarcia Julia PR100% (1)
- Act 2 DeontologiaDocumento18 páginasAct 2 DeontologiajorgemauricioespinozavacaAún no hay calificaciones
- Memoria Explicativa ElectricaDocumento11 páginasMemoria Explicativa Electricasaldana.oscarfelipeAún no hay calificaciones
- Escritos para El Segundo Parcial de DPPDocumento4 páginasEscritos para El Segundo Parcial de DPPEve Cano de Lorenzo0% (1)
- Produccion finALDocumento10 páginasProduccion finALFrandy Pimentel QuelizAún no hay calificaciones
- Elementos para Redactar El Protocolo de InvestigacionDocumento22 páginasElementos para Redactar El Protocolo de InvestigacionArturo Lopez Yañez Blanco100% (1)
- Amplificador OperacionalDocumento21 páginasAmplificador OperacionalCindy RomeroAún no hay calificaciones
- Texto de PreguntasDocumento14 páginasTexto de PreguntasdgaxiolacamposAún no hay calificaciones
- Peralta Llamoca ElizabethDocumento1 páginaPeralta Llamoca ElizabethUriel Ronaldo HCAún no hay calificaciones
- Poesía Nueva Zelanda Tomo IVDocumento3 páginasPoesía Nueva Zelanda Tomo IVKobaAún no hay calificaciones
- Evaluacion Del 25 de GeneticaDocumento8 páginasEvaluacion Del 25 de GeneticaCarlos PlataAún no hay calificaciones
- PSICOMOTRICIDADDocumento232 páginasPSICOMOTRICIDADYESENIA VANESSA TABANGO CHILUIZAAún no hay calificaciones
- Guía 12Documento2 páginasGuía 12Victoria AldunateAún no hay calificaciones
- Habilidades de Un GerenteDocumento2 páginasHabilidades de Un GerenteDeyanira Ramirez GutierrezAún no hay calificaciones
- Ensayo Sitio Del SucesoDocumento17 páginasEnsayo Sitio Del SucesoOvidio HernandezAún no hay calificaciones