Réaction de Ugi
En chimie organique, la réaction de Ugi est une réaction à plusieurs composants impliquant une cétone ou un aldéhyde, une amine, un isonitrile et un acide carboxylique pour former un bis-amide[1],[2],[3],[4].
La réaction est nommée en l'honneur d'Ivar Karl Ugi, qui est le premier à l'avoir recensée en 1959.
Caractéristiques physiques
[modifier | modifier le code]
La réaction est exothermique et se produit généralement en quelques minutes après l'ajout de l'isonitrile. De fortes concentrations (0,5M - 2,0M) de réactifs donnent les meilleurs rendements. Des solvants polaires et aprotiques tels le DMF fonctionnent bien, ainsi que d'autres types tels le méthanol et l'éthanol. Cette réaction non-catalysée possède un haut rendement atomique (en), alors qu'une seule molécule d'eau est perdue, ainsi qu'un haut rendement chimique[5],[6],[7],[8],[9],[10],[11].
Les produits de la réaction étant possiblement des analogues de protéines (en), celle-ci est l'objet de plusieurs tentatives de énantioselectivité afin d'obtenir le produit désiré en plus grande proportion que son image miroir. Ceci a d'ailleurs été réussi en 2018[12],[13].
Réaction
[modifier | modifier le code]L'un des possibles mécanismes réactionnels est illustré ci-dessous[14] :
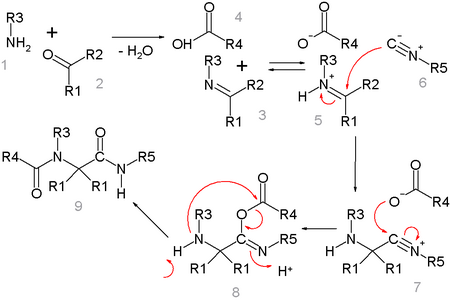
L'amine 1 et la cétone 2 forment l'imine (en) 3 avec pour perte l'équivalent d'une molécule d'eau. L'échange de proton avec l'acide carboxylique 4 active l'ion iminium 5 pour l' addition nucléophile de l'isonitrile 6 avec l'ion nitrilium 7. Une deuxième addition nucléophile prend alors place avec l'anion d'acide carboxylique 8. L'étape finale est un réarrangement de Mumm avec le transfert du groupement acyle R4 de l'oxygène avec l'azote. Toutes les étapes sont réversibles, à l'exception du réarangement de Mumm.
Un parallèle peut être fait avec la réaction de Passerini (sans l'amine), où l'isonitrile réagit directement avec le groupe carbonyle. D'ailleurs, cette réaction peut faire concurrence à la réaction de Ugi et devenir une cause d'impuretés.
Variations
[modifier | modifier le code]L’usage de composés dans une réaction bi-fonctionnelle (ou 2 fonctions ?) augmente la diversité des produits obtenus. De cette façon plusieurs combinaisons emmènent à des produits avec des structures chimiques intéressantes. La réaction de Ugi a été utilisée en combinaison avec une réaction intramoléculaire Diels-Alder dans une synthèse ? procédé ? à plusieurs étapes allongé. L’une des réactions qui en découle (ou des réactions propres ?) est celle de Ugi-Smiles avec la composante acide carboxylique qui est remplacée par un phénol. Dans cette réaction, le réarrangement de Mumm est remplacé par celui de Smiles. Une autre combinaison avec un différent traitement ? est celle avec la réaction de Buchwald-Hartwig. Dans celle de Ugi-Heck un couplage ? Heck aryl survient en deuxième étape.
Applications
[modifier | modifier le code]La réaction de Ugi est l'une des premières réactions chimiques à être utilisée explicitement pour le développement de chimiothèques. Celles-ci sont des configurations de composés qui peuvent être testés à répétition. Utilisant des principes de chimie combinatoire, la réaction de Ugi permet de synthétiser un grand nombre de composés en une seule réaction, par la combinaison d'une variété de cétones (ou aldéhydes), amines, isocyanides et acides carboxyliques. Ces chimiothèques peuvent être utilisées avec des enzymes ou des organismes vivants pour synthétiser de nouvelles substances pharmaceutiques.
La réaction de Ugi peut ainsi donner, en combinaison avec la réaction de Heck, de l'isoquinoline[15]. Elle peut également produire de l'indinavir de marque Crixivan[16]. Elle peut également mener à la fabrication d'anesthésiques tels que la lidocaine et de la bupivacaine.
En , plusieurs séries de réactions de Ugi sont analysées par des chercheurs dans le cadre de la recherche de traitements contre la COVID-19[17].
Notes et références
[modifier | modifier le code]- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Ugi reaction » (voir la liste des auteurs).
- (de) Ugi I, Meyr R, Fetzer U, Steinbrückner C, « Versuche mit Isonitrilen », Angew. Chem., vol. 71, no 11, , p. 386 (DOI 10.1002/ange.19590711110)
- (de) Ugi I, Steinbrückner C, « Über ein neues Kondensations-Prinzip », Angew. Chem., vol. 72, nos 7–8, , p. 267–268 (DOI 10.1002/ange.19600720709)
- (en) Ugi, I., « The α-Addition of Immonium Ions and Anions to Isonitriles Accompanied by Secondary Reactions », Angewandte Chemie International Edition in English, vol. 1, no 1, , p. 8–21 (DOI 10.1002/anie.196200081)
- (en) Boltjes A, Liu H, Liu H, Dömling A, « Ugi Multicomponent Reaction », Org. Synth., vol. 94, , p. 54–65 (DOI 10.15227/orgsyn.094.0054, lire en ligne)
- (en) Ugi I, Lohberger S, Karl R, Comprehensive Organic Synthesis, vol. 2, Oxford, Pergamon, , 1083–1109 p. (ISBN 0-08-040593-2), « The Passerini and Ugi Reactions »
- (en) Ugi I, Werner B, Dömling A, « The Chemistry of Isocyanides, their MultiComponent Reactions and their Libraries », Molecules, vol. 8, , p. 53–66 (DOI 10.3390/80100053, S2CID 53949436, lire en ligne)
- (en) Banfi L, Riva R, Organic Reactions, vol. 65, Wiley, (ISBN 0-471-68260-8), « The Passerini Reaction »)
- (en) Tempest PA, « Recent advances in heterocycle generation using the efficient Ugi multiple-component condensation reaction », Current Opinion in Drug Discovery & Development, vol. 8, no 6, , p. 776–88 (PMID 16312152)
- (en) Ugi I, Heck S, « The multicomponent reactions and their libraries for natural and preparative chemistry », Combinatorial Chemistry & High Throughput Screening, vol. 4, no 1, , p. 1–34 (PMID 11281825, DOI 10.2174/1386207013331291)
- (en) Bienayme H, Hulme C, Oddon G, Schmitt P, « Maximizing synthetic efficiency: multi-component transformations lead the way », Chemistry, vol. 6, no 18, , p. 3321–9 (PMID 11039522, DOI 10.1002/1521-3765(20000915)6:18<3321::AID-CHEM3321>3.0.CO;2-A)
- (en) Dömling A, Ugi I, « Multicomponent Reactions with Isocyanides », Angewandte Chemie, vol. 39, no 18, , p. 3168–3210 (PMID 11028061, DOI 10.1002/1521-3773(20000915)39:18<3168::AID-ANIE3168>3.0.CO;2-U)
- (en) Wang Q, Wang DX, Wang MX, Zhu J, « Still Unconquered: Enantioselective Passerini and Ugi Multicomponent Reactions », Accounts of Chemical Research, vol. 51, no 5, , p. 1290–1300 (PMID 29708723, DOI 10.1021/acs.accounts.8b00105)
- (en) Zhang J, Yu P, Li SY, Sun H, Xiang SH, Wang JJ, Houk KN, Tan B, « Asymmetric phosphoric acid-catalyzed four-component Ugi reaction », Science, vol. 361, no 6407, , eaas8707 (PMID 30213886, DOI 10.1126/science.aas8707)
- (en) Denmark SE, Fan Y, « Catalytic, enantioselective alpha-additions of isocyanides: Lewis base catalyzed Passerini-type reactions », The Journal of Organic Chemistry, vol. 70, no 24, , p. 9667–76 (PMID 16292793, DOI 10.1021/jo050549m)
- (en) Xiang Z, Luo T, Lu K, Cui J, Shi X, Fathi R, Chen J, Yang Z, « Concise synthesis of isoquinoline via the Ugi and Heck reactions », Organic Letters, vol. 6, no 18, , p. 3155–8 (PMID 15330611, DOI 10.1021/ol048791n)
- (en) Rossen K, Pye PJ, DiMichele LM, Volante RP, Reider PJ, « An efficient asymmetric hydrogenation approach to the synthesis of the Crixivan piperazine intermediate », Tetrahedron Letters, vol. 39, no 38, , p. 6823–6826 (DOI 10.1016/S0040-4039(98)01484-1)
- (en) « COVID Moonshot Sprint 4 »,
