Holmium(III)-oxid
| Holmium(III)-oxid | |||
 Holmium(III)-oxid minták átlagos-, és háromszínű megvilágításban | |||
| IUPAC-név | Holmium(III)-oxid | ||
| Más nevek | Holmium-oxid, Holmia | ||
| Kémiai azonosítók | |||
|---|---|---|---|
| CAS-szám | 12055-62-8 | ||
| PubChem | 4232365 | ||
| ChemSpider | 3441223 | ||
| EINECS-szám | 235-015-3 | ||
| |||
| |||
| InChIKey | JYTUFVYWTIKZGR-UHFFFAOYSA-N | ||
| Kémiai és fizikai tulajdonságok | |||
| Kémiai képlet | Ho2O3 | ||
| Moláris tömeg | 377,86 g/mol | ||
| Megjelenés | Halványsárga, átlátszatlan kristályok | ||
| Sűrűség | 8.41 g/cm³ | ||
| Olvadáspont | 2415 °C | ||
| Forráspont | 3900 °C | ||
| Tiltott sáv | 5.3 eV[1] | ||
| Törésmutató (nD) | 1.8[1] | ||
| Kristályszerkezet | |||
| Kristályszerkezet | Köbös, cI80 | ||
| Tércsoport | Ia-3, No. 206 | ||
| Termokémia | |||
| Std. képződési entalpia ΔfH |
-1880.7 kJ mol-1 | ||
| Standard moláris entrópia S |
158.2 J mol-1 K-1 | ||
| Hőkapacitás, C | 115.0 J mol-1 K-1 | ||
| Veszélyek | |||
| MSDS | External MSDS | ||
| S mondatok | S22, S24/25 | ||
| Rokon vegyületek | |||
| Azonos kation | Holmium(III)-klorid | ||
| Azonos anion | Diszprózium(III)-oxid Erbium(III)-oxid | ||
| Rokon vegyületek | Bizmut(III)-oxid Európium(III)-oxid | ||
| Ha másként nem jelöljük, az adatok az anyag standardállapotára (100 kPa) és 25 °C-os hőmérsékletre vonatkoznak. | |||
A holmium(III)-oxid vagy holmium-oxid holmium és oxigén által alkotott vegyület, képlete Ho2O3 A diszprózium(III)-oxiddal együtt az eddig ismert egyik legerősebben paramágneses anyag. A holmium(III)-oxid, más néven holmia a természetben más oxidokkal, például erbium(III)-oxiddal keverve fordul elő, annak ásványtani neve erbia. Általában a három vegyértékű lantanoidák egymás mellett vannak a természetben, szétválasztásuk speciális eljárást igényel. A holmium(III)-oxidot a különleges színezett üvegek gyártásakor használnak. A holmium-oxidot tartalmazó üvegek és oldatok a látható hullámhossz-tartományban egy sor éles elnyelési (abszorpciós) csúccsal rendelkeznek. Ezért ezeket hagyományosan mint könnyen használható kalibrációs etalon használják optikai spektrofotométerekhez.
Tulajdonságai
[szerkesztés]Megjelenés
[szerkesztés]A holmium(III)-oxid a megvilágítási körülményektől függően meglehetősen drámai színváltozásra képes. Napfényen csersárga színű. Háromszínű fény alatt tüzes narancs-vörös, ilyen megvilágításban szinte megkülönböztethetetlen az erbium(III)-oxidtól. A holmium(III)-oxid tiltott sávja széles, 5,3 eV, így színtelen megjelenésűnek kellene lennie. Sárga színe a sűrű kristályrácsok hiányosságaiból ered, amik a Ho3+ ionok mozgása miatt vannak a kristályon belül.
Kristályszerkezete
[szerkesztés]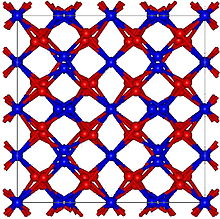
A holmium-oxid szerkezete köbös, de komplex, több atomot tartalmazó elemi cellával. Rácsállandója 1,06 nanométer. Az efféle szerkezet tipikusan a ritkaföldfémek oxidjaira jellemző. A holmium-oxidéval azonos például a Tb2O3, Dy2O3, Er2O3, Tm2O3, Yb2O3, és a Lu2O3. A Ho2O3 hőtágulási együtthatója viszonylag nagy: 7,4 ×10−6/°C.[2]
Kémiája
[szerkesztés]A holmium(III)-oxid a hidrogén-kloriddal és az ammónium-kloriddal is reakcióba lép, holmium(III)-kloriddá alakul:[3]
Története
[szerkesztés]A holmiumot Marc Delafontaine és Jacques-Louis Soret fedezte fel 1878-ban. Felfigyeltek az akkor még ismeretlen elem (ők még "X-elemként" tartották számon) szokatlan spektrográfiai abszorpciós sávjaira.[4][5] Tőlük függetlenül, szintén 1878-ban Per Teodor Cleve az erbiát, vagyis az erbium-oxid ércét vizsgálva felfedezte a holmiumot.[6][7]
Azt a módot használva, amit Carl Gustaf Mosander fejlesztett ki, Cleve először elvonta az összes ismert szennyeződést az erbiától. Az erőfeszítése eredményéül két új anyagot, egy barnát és egy zöldet kapott. A barna anyag neve (az otthona, Stockholm latin neve után) holmia lett, a zöldé pedig túlia. Később kiderült, hogy a holmia valójában holmium-oxid, a túlia pedig túlium-oxid.[8]
Előfordulása
[szerkesztés]
A holmium-oxid nyomokban előfordul a gadolinitben és a monazitban, valamint egyéb ritkaföldfém-ásványokban. A fém holmium könnyen oxidálódik a levegőn; ezért a természetben a holmium szó rokon értelmű a holmiával (holmium-oxid érccel). A földkéreg átlagosan kilogrammonként 1,4 milligrammot tartalmaz, ezzel a holmium az 56. leggyakoribb elem a Földön. A fő bányászterületekhez tartozik Kína, az Egyesült Államok, Brazília, Srí Lanka és Ausztrália, a becsült tartalék 400 000 tonna holmium-oxid.[9]
Gyártása
[szerkesztés]A holmium-oxid kivonása leegyszerűsítve a következőképpen zajlik: Először az ásványi keverékeket porrá zúzzák. A monazitot –mágneses tulajdonságai végett– ismételt elektromágneses elválasztással különítik el. Az elkülönítést követően a keveréket forró, tömény kénsavval kezelik, hogy számos ritkaföldfém vízoldékony szulfátját kinyerjék. Leszűrés után a savas folyadékhoz annyi nátrium-hidroxidot adnak, amennyi a kémhatását pH 3-4 értékűre emeli. Ilyenkor a tórium vegyületei (hidroxidként) csapadék formájában kiválnak az oldatból. Ezután ammónium-oxalátot kevernek a folyadékhoz, hogy vízben oldhatatlan ritkaföldfém-oxalátokat kapjanak. Az oxalátok hevítés hatására oxidokká bomlanak. Ezekhez salétromsavat adnak, ezzel kizárják a fő komponensek egyikét, a cériumot, amelynek oxidja nem lép reakcióba salétromsavval.[9]
A leghatékonyabb elválasztási folyamat, amellyel a holmium-oxidot a többi ritkaföldfémtől elkülönítik az ioncsere. A ritkaföldfém-vegyületeket megfelelő ioncserélő gyantával keverik össze, hogy hidrogén-, ammónium- vagy rézionnal (amik az adott gyantában előfordulnak) helyettesítsék a kinyerendő fémet. A ritkaföldfém-ionok szelektíven elválaszthatóak egymástól a megfelelő komplexképző anyaggal, például ammónium-citráttal vagy nitriotriacetáttal.[3]
Felhasználása
[szerkesztés]
A holmium-oxid egy cirkónia vagy üveg megfestésére használt színezék, amely sárga vagy vörös színt ad.[10] A holmium-oxidot vagy annak (általában perklórsavas) oldata éles elnyelési (abszorpciós) csúccsal rendelkeznek 200-900 nm tartományban, ezért optikai spektrofotométerek kalibrációs etalonjaként használják.[11][12] Ahogy egyéb ritkaföldfém-oxidok, a holmium-oxid is alkalmazható speciális katalizátorokban, fényporokban és lézerekben.[13] A Holmium lézer 2,08 mikrométeres tartományban működik impulzus vagy folyamatos rendszerben. E lézer a szemre biztonságos, felhasználási területei: orvosi, LIDAR, szélsebesség mérés, atmoszféra monitorozás.
Egészségtani hatásai
[szerkesztés]A holmium(III)-oxid –sok más vegyülethez hasonlóan– nem túl veszélyes, bár túladagolása esetén felléphet a glanulóma és a hemoglobinémia betegség. Lenyelve vagy belélegezve enyhe a toxicitása, a bőrt nem irritálja. Az akut, orálisan bevitt holmium-oxid halálos adagjának középértéke (LD50) nagyobb, mint 1 gramm / testsúlykilogramm.[14]
Fordítás
[szerkesztés]Ez a szócikk részben vagy egészben a Holmium(III)-oxide című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.
Források
[szerkesztés]- ↑ a b Wiktorczyk, T (2002). „Preparation and optical properties of holmium oxide thin films”. Thin Solid Films 405, 238. o. DOI:10.1016/S0040-6090(01)01760-6.
- ↑ Singh, H (1969). „Precise determination of the lattice parameters of holmium and erbium sesquioxides at elevated temperatures”. Journal of the Less Common Metals 18 (2), 172. o. DOI:10.1016/0022-5088(69)90137-4.
- ↑ a b Patnaik, Pradyot. Handbook of Inorganic Chemical Compounds. McGraw-Hill, 340;445. o. (2003). ISBN 0-07-049439-8. Hozzáférés ideje: 2009. június 6.
- ↑ Jacques-Louis Soret (1878). „Sur les spectres d'absorption ultra-violets des terres de la gadolinite”. Comptes rendus de l'Académie des sciences 87, 1062. o.
- ↑ Jacques-Louis Soret (1879). „Sur le spectre des terres faisant partie du groupe de l'yttria”. Comptes rendus de l'Académie des sciences 89, 521. o.
- ↑ Per Teodor Cleve (1879). „Sur deux nouveaux éléments dans l'erbine”. Comptes rendus de l'Académie des sciences 89, 478. o.
- ↑ Per Teodor Cleve (1879). „Sur l'erbine”. Comptes rendus de l'Académie des sciences 89, 708. o.
- ↑ John Emsley. Nature's building blocks: an A-Z guide to the elements. US: Oxford University Press, 180–181. o. (2001). ISBN 0-19-850341-5
- ↑ a b John Emsley. Nature's building blocks: an A-Z guide to the elements. US: Oxford University Press, 181–182. o. (2001). ISBN 0-19-850341-5
- ↑ Cubic zirconia. [2009. április 24-i dátummal az eredetiből archiválva]. (Hozzáférés: 2009. június 6.)
- ↑ R. P. MacDonald (1964). „Uses for a Holmium Oxide Filter in Spectrophotometry”. Clinical Chemistry 10 (12), 1117–20. o. [2011. december 5-i dátummal az eredetiből archiválva]. PMID 14240747. (Hozzáférés: 2014. június 19.)
- ↑ Travis, John C. (2002). „An International Evaluation of Holmium Oxide Solution Reference Materials for Wavelength Calibration in Molecular Absorption Spectrophotometry”. Analytical Chemistry 74 (14), 3408–15. o. DOI:10.1021/ac0255680. PMID 12139047.
- ↑ Yehoshua Y. Kalisky. The physics and engineering of solid state lasers. SPIE Press, 125. o. (2006). ISBN 0-8194-6094-X
- ↑ External MSDS. [2008. március 9-i dátummal az eredetiből archiválva]. (Hozzáférés: 2009. június 6.)

