Hidronium
| |||
| |||
| Nama | |||
|---|---|---|---|
| Nama IUPAC
oksonium
| |||
| Nama lain
ion hidronium
| |||
| Penanda | |||
Model 3D (JSmol)
|
|||
| 3DMet | {{{3DMet}}} | ||
| ChEBI | |||
| ChemSpider | |||
| Nomor EC | |||
PubChem CID
|
|||
| Nomor RTECS | {{{value}}} | ||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| Sifat | |||
| H3O+ | |||
| Massa molar | 19.02 g/mol | ||
| Keasaman (pKa) | −1.7 | ||
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |||
| Referensi | |||
Dalam kimia, hidronium merupakan nama umum bagi kation berair H3O+, jenis ion oksonium yang dihasilkan melalui protonasi air. Ion ini merupakan ion positif yang hadir ketika suatu asam Arrhenius terlarut dalam air, karena molekul asam Arrhenius dalam larutan melepaskan sebuah proton (suatu ion hidrogen positif, H+) terhadap molekul air di sekelilingnya (H2O).
Penentuan pH
[sunting | sunting sumber]Jumlah ion hidronium relatif terhadap ion hidroksida merupakan hal yang menentukan nilai pH dari suatu larutan. Molekul dalam air murni mengalami auto-disosiasi (yakni: bereaksi satu sama lain) menjadi ion hidronium dan hidroksida dalam kesetimbangan berikut:
- 2 H2O
 OH− + H3O+
OH− + H3O+
Dalam air murni, terdapat jumlah setara dari ion hidroksida dan hidronium, sehingga larutan bersifat netral. Pada 25 °C, air memiliki pH 7 (nilai ini bervariasi ketika suhu berubah). Suatu nilai pH yang kurang dari 7 menunjukkan larutan bersifat asam, dan suatu nilai pH lebih dari 7 menunjukkan larutan bersifat basa.
Tata nama
[sunting | sunting sumber]Menurut tata nama IUPAC mengenai kimia organik, ion hidronium sebaiknya dirujuk sebagai oksonium.[1] Hidroksonium dapat pula digunakan secara jelas untuk mengidentifikasinya. Rancangan usulan IUPAC juga merekomendasikan penggunaan oksonium dan oksidanium dalam konteks kimia organik dan anorganik, masing-masing.
Suatu ion oksonium adalah setiap ion dengan kation oksigen trivalensi. Misalnya, gugus hidroksil terprotonasi adalah ion oksonium, namun bukanlah ion hidronium.
Struktur
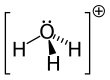
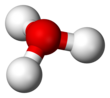
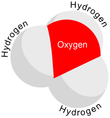
[sunting | sunting sumber]Karena O+ dan N memiliki jumlah elektron yang sama, H3O+ adalah isoelektronik dengan amonia. Seperti ditunjukkan pada gambar di atas, H3O+ memiliki sebuah geometri molekul trigonal piramida dengan atom oksigen pada puncaknya. Sudut ikatan H–O–H kira-kira sebesar 113°,[2] dan pusat massa sangat dekat dengan atom oksigen. Karena dasar piramida terdiri dari tiga atom hidrogen yang identik, konfigurasi atas simetri molekul H3O+ seperti halnya termasuk dalam kelompok point group C3v. Karena simetri ini dan fakta bahwa ia memiliki momen dipol, aturan seleksi rotasi ini adalah ΔJ = ±1 dan ΔK = 0. Dipol transisi terletak di sepanjang sumbu-c dan, karena muatan negatif terlokalisasi dekat atom oksigen, momen dipol mengarah ke puncak, tegak lurus terhadap bidang dasar.
Asam dan keasaman
[sunting | sunting sumber]Hidronium adalah kation yang terbentuk dari air dengan keberadaan ion hidrogen. Hidron ini tidak ada dalam keadaan bebas: mereka sangat reaktif dan terlarut oleh air. Suatu zat terlarut asam umumnya merupakan sumber hidron ini; Namun, hidronium terdapat bahkan dalam air murni. Kasus khusus ini di mana air bereaksi dengan air untuk menghasilkan hidronium (dan hidroksida) ion umumnya dikenal sebagai ionisasi diri air. Ion hidronium yang dihasilkan sedikit dan berumur pendek. pH merupakan ukuran aktivitas relatif hidronium dan ion hidroksida dalam larutan berair. Dalam larutan asam, hidronium lebih aktif, proton berlebihnya siap tersedia untuk reaksi dengan spesi basa.
Ion hidronium sangat asam: pada 25 °C, pKanya adalah −1.7. Hal ini merupakan spesi yang paling asam yang dapat berada dalam air (dengan asumsi air yang cukup untuk pelarutan): asam yang kuat akan mengionisasi dan memprotonasi molekul air untuk membentuk hidronium. Keasaman hidronium merupakan standar implisit digunakan untuk menilai kekuatan asam dalam air: asam kuat haruslah donor proton yang lebih baik dari hidronium, jika tidak sebagian besar asam akan berada dalam keadaan non-terionisasi (yaitu: asam lemah). Tidak seperti hidronium dalam larutan netral yang dihasilkan dari autodisosiasi air, ion hidronium dalam larutan asam ini adalah tahan lama dan terkonsentrasi, sebanding dengan kekuatan asam terlarut.
pH awalnya disusun untuk menjadi ukuran konsentrasi ion hidrogen pada larutan berair.[3] Hampir semua proton bebas cepat bereaksi dengan air untuk membentuk hidronium; keasaman larutan berair dengan demikian lebih akurat ditandai dengan konsentrasi hidronium nya. Dalam sintesis organik, seperti reaksi yang dikatalisis-asam, ion hidronium (H3O+) dapat digunakan bergantian dengan ion H+; memilih salah satu atas yang lain tidak berdampak signifikan pada mekanisme reaksi.
Solvasi
[sunting | sunting sumber]Para peneliti belum sepenuhnya mengkarakterisasi solvasi dari ion hidronium dalam air, sebagian karena banyak pengertian yang berbeda dari solvasi yang hadir. Sebuah studi penurunan titik beku menentukan bahwa hidrasi rata-rata ion dalam air dingin kira-kira H3O+(H2O)6:[4] rata-rata, setiap ion hidronium tersolvasi dalam 6 molekul air yang tidak dapat mensolvasi molekul terlarut lainnya.
Beberapa struktur hidrasi cukup besar: struktur jumlah ion ajaib H3O+(H2O)20 (disebut ajaib karena stabilitasnya yang meningkat sehubungan dengan struktur hidrasi yang melibatkan sejumlah sebanding molekul air - hal ini adalah penggunaan yang sama dari kata ajaib seperti dalam fisika nuklir) mungkin menempatkan hidronium dalam sebuah kurungan dodekahedral.[5] Namun, simulasi dinamika molekuler dengan metode ab initio yang terbaru menunjukkan bahwa, rata-rata, proton terhidrasi berada pada permukaan cluster H3O+(H2O)20.[6] Lebih jauh, beberapa fitur yang berbeda dari simulasi ini sependapat dengan mitra eksperimental mereka yang mengusulkan interpretasi alternatif dari hasil penelitian ini.

Dua struktur yang dikenal lainnya adalah kation Zundel dan kation Eigen. Struktur solvasi Eigen memiliki ion hidronium pada pusat kompleks H9O+4 di mana hidronium terikat-hidrogen dengan kuat pada tiga molekul air yang berdekatan.[7] Dalam kompleks Zundel H5O+2 proton dibagi sama rata dengan dua molekul air dalam suatu ikatan hidrogen simetris.[8] Penelitian terbaru menunjukkan bahwa kedua kompleks ini merupakan struktur yang ideal dalam cacat jaringan ikatan hidrogen yang lebih umum.[9]
Isolasi dari monomer ion hidronium dalam fase cair dicapai dalam larutan superasam berair dengan nukleofilisitas rendah (HF-SbF5SO2). Ion tersebut dikarakterisasi dengan resonansi magnet inti 17O.[10]
Sebuah perhitungan tahun 2007 mengenai entalpi dan energi bebas pada beragam ikatan hidrogen di sekitar kation hidronium pada air cairan terprotonasi[11] pada suhu kamar dan sebuah studi mengenai mekanisme lompatan proton menggunakan simulasi dinamika molekul menunjukkan bahwa ikatan hidrogen di sekitar ion hidronium (dibentuk dengan tiga ligan air dalam kulit solvasi pertama hidronium) yang cukup kuat dibandingkan dengan air dalam jumlah besar.
Sebuah model baru diusulkan oleh Stoyanov[12] berdasarkan spektroskopi inframerah di mana proton hadir sebagai suatu ion H13O+6. Muatan positif karenanya terdelokalisasi di sekeliling 6 molekul air.
Lihat pula
[sunting | sunting sumber]- Hidron (kation hidrogen)
- Hidrida
- Ion hidrogen
- Deuterium
- Tritium
Referensi
[sunting | sunting sumber]- ^ Mononuclear parent onium ions. IUPAC
- ^ Jian Tang and Takeshi Oka (1999). "Infrared spectroscopy of H3O+: the v1 fundamental band". J. Mol. Spectrosc. 196 (1): 120–130. Bibcode:1999JMoSp.196..120T. doi:10.1006/jmsp.1999.7844. PMID 10361062.
- ^ Sorensen, S. P. L. (1909). "Ueber die Messung und die Bedeutung der Wasserstoffionenkonzentration bei enzymatischen Prozessen". Biochem. Zeitschr. 21: 131–304.
- ^ Zavitsas, A. A. (2001). "Properties of water solutions of electrolytes and nonelectrolytes". J. Phys. Chem. B. 105 (32): 7805–7815. doi:10.1021/jp011053l.
- ^ Hulthe, G.; Stenhagen, G.; Wennerström, O.; Ottosson, C-H. (1997). "Water cluster studied by electrospray mass spectrometry". J. Chromatogr. A. 512: 155–165. doi:10.1016/S0021-9673(97)00486-X.
- ^ Iyengar, S. S.; Petersen, M. K.; Burnham, C. J.; Day, T. J. F.; Voth, G. A.; Voth, G. A. (2005). "The Properties of Ion-Water Clusters. I. The Protonated 21-Water Cluster" (PDF). J. Chem. Phys. 123 (8): 084309. Bibcode:2005JChPh.123h4309I. doi:10.1063/1.2007628. PMID 16164293.
- ^ Zundel, G.; Metzger, H. (1968). "Energiebänder der tunnelnden Überschuß-Protonen in flüssigen Säuren. Eine IR-spektroskopische Untersuchung der Natur der Gruppierungen H5O+2". Z. Phys. Chem. 58 (5_6): 225–245. doi:10.1524/zpch.1968.58.5_6.225.
- ^ Wicke, E.; Eigen, M.; Ackermann, Th (1954). "Über den Zustand des Protons (Hydroniumions) in wäßriger Lösung". Z. Phys. Chem. 1 (5_6): 340–364. doi:10.1524/zpch.1954.1.5_6.340.
- ^ Marx, D.; Tuckerman, M. E.; Hutter, J.; Parrinello, M. (1999). "The nature of the hydrated excess proton in water". Nature. 397 (6720): 601–604. Bibcode:1999Natur.397..601M. doi:10.1038/17579.
- ^ Mateescu, G. D.; Benedikt, G. M. (1979). "Water and related systems. 1. The hydronium ion (H3O+). Preparation and characterization by high resolution oxygen-17 nuclear magnetic resonance". Journal of the American Chemical Society. 101 (14): 3959–3960. doi:10.1021/ja00508a040.
- ^ Markovitch, O.; Agmon, N. (2007). "Structure and Energetics of the Hydronium Hydration Shells" (PDF). The Journal of Physical Chemistry A. 111 (12): 2253–6. doi:10.1021/jp068960g. PMID 17388314. Diarsipkan dari versi asli (PDF) tanggal 2014-08-13. Diakses tanggal 2017-03-14.
- ^ Stoyanov, E. S.; Stoyanova, I. V.; Reed, C. A. (2010). "The Structure of the Hydrogen Ion (H+aq) in Water". Journal of the American Chemical Society. 132 (5): 1484–5. doi:10.1021/ja9101826. PMC 2946644
 . PMID 20078058.
. PMID 20078058.