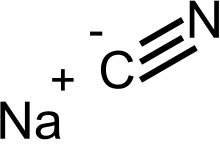വിക്കിപീഡിയ, ഒരു സ്വതന്ത്ര വിജ്ഞാനകോശം.
സോഡിയം സയനൈഡ് (Sodium cyanide)
Identifiers
ChEMBL
ChemSpider
ECHA InfoCard 100.005.091
EC Number
RTECS number
UN number
1689
InChI
SMILES
Properties
തന്മാത്രാ വാക്യം
Molar mass
0 g mol−1
Appearance
white solid
Odor
faint almond-like
സാന്ദ്രത
1.5955 g/cm3
ദ്രവണാങ്കം
ക്വഥനാങ്കം
48.15 g/100 mL (10 °C)
Solubility
soluble in ammonia , methanol , ethanol dimethylformamide , SO2 dimethyl sulfoxide
Refractive index (n D )
1.452
Thermochemistry
Std enthalpy of Δf H o 298
-91 kJ/mol
Standard molar S o 298
115.7 J/mol K
Specific heat capacity , C
70.4 J/mol K
Hazards
Safety data sheet
ICSC 1118
EU classification
{{{value}}}
R-phrases
R26/27/28 R32 R50/53
S-phrases
(S1/2) S7 S28 S29 S45 S60 S61
Flash point
{{{value}}}
Lethal dose or concentration (LD, LC):
6.44 mg/kg (rat, oral)[ 2]
NIOSH
TWA 5 mg/m3
C 5 mg/m3 (4.7 ppm) [10-minute]
25 mg/m3 (as CN)
Related compounds
Other cations
Potassium cyanide
Except where otherwise noted, data are given for materials in their
standard state (at 25 °C [77 °F], 100 kPa).
ഒരു അകാർബണിക സയനൈഡ് സംയുക്തമാണ് സോഡിയം സയനൈഡ് (Sodium cyanide). ഇതിന്റെ തന്മാത്രാ സൂത്രം Na C N എന്നാണ്. വെളുത്ത ഈ ഖരപദാർത്ഥം വെള്ളത്തിൽ നന്നായി ലയിക്കുന്നു. മാരകമായ ഒരു വിഷപദാർത്ഥമാണിത്. സ്വർണ്ണ ഖനനത്തിൽ ഇതിന് പ്രമുഖ സ്ഥാനമുണ്ട്. അമ്ലവുമായി പ്രതിപ്രവർത്തിച്ച് ഹൈഡ്രജൻ സയനൈഡ് എന്ന വിഷവാതകം ഉണ്ടാവുന്നു.:
NaCN + H2 SO4 → HCN + NaHSO4 ഹൈഡ്രജൻ സയനൈഡ് സോഡിയം ഹൈഡ്രോക്സൈസൈഡുമായി പ്രവർത്തിപ്പിച്ചാണ് സോഡിയം സയനൈഡ് നിർമ്മിക്കുന്നത്.:[ 3]
HCN + NaOH → NaCN + H2 O ലക്ഷക്കണക്കിന് ടൺ സംയുക്തമാണ് ഓരോ വർഷവും നിർമ്മിക്കപ്പെടുന്നത്. സോഡിയം അമൈഡ് ഉയർന്ന താപനിലയിൽ കാർബണുമായി പ്രവർത്തിപ്പിച്ച് കാസ്റ്റ്നർ പ്രക്രിയ വഴിയാണ് ആദ്യകാലങ്ങളിൽ സോഡിയം സയനൈഡ് നിർമ്മിച്ചിരുന്നത്.
NaNH2 + C → NaCN + H2 sodium chloride കറിയപ്പിന്റെ തന്മാത്രാ ഘടനയോട് സാദൃശ്യമുള്ളതാണ് NaCN ഘടനയും.[ 4] പൊട്ടാസ്യം സയനൈഡിനും സദൃശ ഘടന തന്നെയാണുള്ളത്. ഓരോ Na+ അയോണും CN− അയോണുമായി പൈ-ബോണ്ടിലേർപ്പെടുന്നു.[ 5] ഹൈഡ്രോളിസിസ് പ്രവർത്തനത്തിന് വിധേയമായി HCN എന്ന വിഷവാതകം പുറപ്പെടുവിക്കുന്നു. ഇതിന്റെ കയ്പുള്ള ബദാം ഗന്ധം ചിലർക്ക് തിരിച്ചറിയാനാകും. (ഒരു ജനിതക സവിശേഷതയുള്ളവർക്കേ ഈ ഗന്ധം തിരിച്ചറിയാനാവൂ.[ 6] [ 3]
NaCN + H2 O2 → NaOCN + H2 O സ്വർണ്ണഖനനത്തിൽ, അയിരിൽ നിന്നും സ്വർണ്ണം വേർതിരിക്കുന്നതിന് സോഡിയം സയനൈഡ് ഉപയോഗിക്കുന്നു.
4 Au + 8 NaCN + O2 + 2 H2 O → 4 Na[Au(CN)2 ] + 4 NaOH നിരവധി രാസ സംയുക്തങ്ങൾ നിർമ്മിക്കുന്നതിന് NaCN ഉപയോഗിക്കുന്നു. സയാന്യൂറിക് ക്ലോറൈഡ് , സയനോജൻ ക്ലോറൈഡ് , നൈട്രൈൽ സംയുക്തങ്ങൾ, ബെൻസൈൽ സയനൈഡ് തുടങ്ങിയവയുടെ നിർമ്മാണത്തിൽ സോഡിയം സയനൈഡ് ഉപയോഗിക്കുന്നു.[ 7]
വളരെപ്പെട്ടെന്ന് പ്രവർത്തിക്കുന്ന ഒരു വിഷവസ്തുവാണ് സോഡിയം സയനൈഡ്. ശ്വസനം തടസ്സപ്പെടുത്തിയാണ് ഇത് പ്രവർത്തിക്കുന്നത്. ഇതിന്റെ ഫലമായി ലാക്റ്റിക് അസിഡോസിസ് ഉണ്ടാവുന്നു. വളരെ കുറഞ്ഞ അളവിൽ (200–300 mg) സോഡിയം സയനൈഡ് ശരീരത്തിലെത്തിയാൽപ്പോലും മരണം സംഭവിക്കാം. ഒരു വിഷപദാർത്ഥമായതിനാൽ നിയമവിരുദ്ധ പ്രവർത്തനങ്ങൾക്കും ഉപയോഗിക്കപ്പെടുന്നുണ്ട്. വിഷം ചേർത്തുള്ള മീൻപിടുത്തം നടത്താൻ NaCN ഉപയോഗിച്ചു വരുന്നു.
↑ Oxford MSDS
↑ "Cyanides (as CN)" . Immediately Dangerous to Life and Health . National Institute for Occupational Safety and Health (NIOSH).↑ 3.0 3.1 Andreas Rubo, Raf Kellens, Jay Reddy, Norbert Steier, Wolfgang Hasenpusch "Alkali Metal Cyanides" in Ullmann's Encyclopedia of Industrial Chemistry 2006 Wiley-VCH, Weinheim, Germany. doi :10.1002/14356007.i01_i01
↑ Wells, A.F. (1984) Structural Inorganic Chemistry, Oxford: Clarendon Press. ISBN 0-19-855370-6 .
↑ H. T. Stokes; D. L. Decker; H. M. Nelson; J. D. Jorgensen (1993). "Structure of potassium cyanide at low temperature and high pressure determined by neutron diffraction" . Phys. Rev. B (Submitted manuscript). 47 (17): 11082–11092. doi :10.1103/PhysRevB.47.11082 . ↑ Online Mendelian Inheritance in Man (OMIM) 304300 ↑ Adams, Roger; Thal, A. F. (1922). "Benzyl cyanide". Organic Syntheses . 2 : 9. doi :10.15227/orgsyn.002.0009 .
Institut national de recherche et de sécurité (INRS), "Cyanure de sodium. Cyanure de potassium" , Fiche toxicologique n° 111 , Paris, 2006, 6 pp. (PDF file, in French )* International Chemical Safety Card 1118 * Hydrogen cyanide and cyanides (CICAD 61)
National Pollutant Inventory - Cyanide compounds fact sheet NIOSH Pocket Guide to Chemical Hazards PubChem {{{1}}} CSST (Canada) Archived 2012-02-09 at the Wayback Machine .Sodium cyanide hazards to fish and other wildlife from gold
സയനൈഡ് അയോണിന്റെ ലവണങ്ങളും ഡെറിവേറ്റീവുകളും
HCN
He
LiCN
Be(CN)2
B
C
NH4 CN
OCN− ,-NCO
FCN
Ne
NaCN
Mg(CN)2
Al(CN)3
Si(CN)4 ,Me3 SiCN
P(CN)3
SCN− ,-NCS ,(SCN)2 ,S(CN)2
ClCN
Ar
KCN
Ca(CN)2
Sc(CN)3
Ti(CN)4
Cr(CN)6 4−
Cr(CN)6 3−
Mn(CN)2
Fe(CN)3 ,Fe(CN)6 4− ,Fe(CN)6 3−
Co(CN)2 ,Co(CN)3
Ni(CN)2 Ni(CN)4 2−
CuCN
Zn(CN)2
Ga(CN)3
Ge
As(CN)3
SeCN− (SeCN)2 Se(CN)2
BrCN
Kr
RbCN
Sr(CN)2
Y(CN)3
Zr(CN)4
Nb
Mo(CN)8 4−
Tc
Ru(CN)6 3−
Rh(CN)6 3−
Pd(CN)2
AgCN
Cd(CN)2
In(CN)3
Sn
Sb(CN)3
Te
ICN
Xe
CsCN
Ba(CN)2
Hf
Ta
W(CN)8 4−
Re
Os(CN)6 3−
Ir(CN)6 3−
Pt(CN)4 2- ,Pt(CN)6 4- AuCN ,Au(CN)2 −
Hg2 (CN)2 ,Hg(CN)2
TlCN
Pb(CN)2
Bi(CN)3
Po
At
Rn
Fr
Ra
Rf
Db
Sg
Bh
Hs
Mt
Ds
Rg
Cn
Nh
Fl
Mc
Lv
Ts
Og
↓
La
Ce(CN)3 ,Ce(CN)4
Pr
Nd
Pm
Sm
Eu
Gd(CN)3
Tb
Dy
Ho
Er
Tm
Yb
Lu
Ac
Th
Pa
UO2 (CN)2
Np
Pu
Am
Cm
Bk
Cf
Es
Fm
Md
No
Lr
അസെറ്റോൺ സയനോഹൈഡ്രിൻ ·
അസെറ്റോൺ തയോസെമിക്കാർബാസൈഡ് ·
അക്രോലിൻ ·
അക്രിലാമൈഡ് ·
അക്രിലോനൈട്രൈൽ (അക്രിലോണിട്രൈൽ) ·
അക്രിലോയ്ൽ ക്ലോറൈഡ് ·
അഡിപോനൈട്രൈൽ ·
ആൽഡികാർബ് ·
ആൾഡ്രിൻ ·
അലൈൽ ആൽക്കഹോൾ ·
അല്ലിലാമൈൻ ·
അലൂമിനിയം ഫോസ്ഫൈഡ് (അലുമിനിയം ഫോസ്ഫൈഡ്) ·
അമിനോപ്റ്റെറിൻ ·
അമിറ്റൺ ·
അമിറ്റൺ ഓക്സലേറ്റ് ·
അമോണിയ ·
ആംഫെറ്റാമിൻ ·
അനിലിൻ ·
അനിലിൻ, 2,4,6-ട്രൈമീഥൈൽ- ·
ആന്റിമണി പെന്റാഫ്ളൂറൈഡ് ·
ആന്റിമൈസിൻ എ ·
ANTU (ANTU (ആൽഫാ-നാഫ്തൈൽതയോയൂറിയ) ·
ആർസെനിക് പെന്റോക്സൈഡ് ·
ആഴ്സനിക് ട്രയോക്സൈഡ് (ആഴ്സണസ് ഓക്സൈഡ്) ·
ആഴ്സണസ് ട്രൈക്ലോറൈഡ് ·
ആർസൈൻ ·
അസിൻഫോസ്-എഥൈൽ ·
അസിൻഫോസ്-മെഥൈൽ ·
ബെൻസൽ ക്ലോറൈഡ് ·
ബെൻസെനാമൈൻ, 3- (ട്രൈഫ്ലൂറോമെഥൈൽ) - ·
ബെൻസെനെർസോണിക് ആസിഡ് ·
ബെൻസിമിഡാസോൾ, 4,5-ഡിക്ലോറോ -2- (ട്രൈഫ്ലൂറോമെഥൈൽ) - ·
ബെൻസോട്രൈക്ലോറൈഡ് ·
ബെൻസിൽ ക്ലോറൈഡ് ·
ബെൻസിൽ സയനൈഡ് ·
ബൈസൈക്ലോ (2.2.1) ഹെപ്റ്റൈൻ-2-കാർബോനൈട്രൈൽ ·
ബിസ്(ക്ലോറോമീതൈൽ) കീറ്റോൺ ·
ബിറ്റോസ്കാനേറ്റ് ·
ബോറോൺ ട്രൈക്ലോറൈഡ് ·
ബോറോൺ ട്രൈഫ്ലൂറൈഡ് ·
ബോറോൺ ട്രൈഫ്ലൂറൈഡ് ഡൈമീതൈൽ ഈഥറുമായുള്ള സംയുക്തം ·
ബ്രോമാഡിയോലോൺ ·
ബ്രോമിൻ ·
കാഡ്മിയം ഓക്സൈഡ് ·
കാഡ്മിയം സ്റ്റിയറേറ്റ് ·
കാൽസ്യം ആഴ്സണേറ്റ് ·
കാംഫെക്ലോർ ·
കാന്താരിഡിൻ ·
കാർബക്കോൾ ക്ലോറൈഡ് ·
ഫ്യുറഡാൻ|കാർബോഫുറാൻ ·
കാർബൺ ഡൈസൾഫൈഡ് ·
കാർബോഫെനോത്തിയോൺ ·
ക്ലോർഡെയ്ൻ ·
ക്ലോർഫെൻവിൻഫോസ് ·
ക്ലോറിൻ ·
ക്ലോർമെഫോസ് ·
ക്ലോർമക്വാറ്റ് ക്ലോറൈഡ് ·
ക്ലോറോഅസെറ്റിക് ആസിഡ് ·
2-ക്ലോറോഎത്തനോൾ ·
ക്ലോറോഇഥൈൽ ക്ലോറോഫോർമേറ്റ് ·
ക്ലോറോഫോം ·
ക്ലോറോമീഥൈൽ ഈഥർ ·
ക്ലോറോമീഥൈൽ മീഥൈൽ ഈഥർ ·
ക്ലോറോഫാസിനോൺ ·
ക്ലോറോക്സുറോൺ ·
ക്ലോർത്തിയോഫോസ് ·
ക്രോമിക് ക്ലോറൈഡ് ·
കോബാൾട്ട് കാർബണിൽ ·
കോൾചിസിൻ ·
കൊമാഫോസ് ·
Cresol, -o ·
ക്രിമിഡിൻ ·
ക്രോടോണാൾഡിഹൈഡ് ·
സയനോജെൻ ബ്രോമൈഡ് ·
സയനോജെൻ അയോഡൈഡ് ·
സയനോഫോസ് ·
സയനൂറിക് ഫ്ലൂറൈഡ് ·
സൈക്ലോഹെക്സിമൈഡ് ·
സൈക്ലോഹെക്സിലാമിൻ ·
ഡെക്കാബോറേൻ|ഡെക്കാബോറൻ (14) ·
ഡെമെറ്റൺ ·
ഡിമെറ്റൺ-എസ്-മെഥൈൽ ·
ഡയാലിഫോർ ·
ഡൈബൊറേൻ (ഡിബോറൻ) ·
ഡിക്ലോറോഎഥൈൽ ഈതർ ·
ഡിക്ലോറോമെഥൈൽഫെനൈൽസിലെയ്ൻ ·
ഡിക്ലോർവോസ് ·
ഡിക്രോടോഫോസ് ·
ഡൈപോക്സിബുട്ടെയ്ൻ ·
ഡൈഈഥൈൽ ക്ലോറോഫോസ്ഫേറ്റ് ·
ഡിജിടോക്സിൻ ·
ഡിഗ്ലിസിഡൈൽ ഈതർ ·
ഡിഗോക്സിൻ ·
ഡിമെഫോക്സ് ·
ഡൈമെഥോയേറ്റ് ·
ഡൈമെഥിൽഡൈക്ലോറോസിലെയ്ൻ ·
ഡൈമെഥൈൽഹൈഡ്രാസിൻ ·
ഡൈമെറ്റിലാൻ ·
ഡൈനൈട്രോക്രെസോൾ ·
ഡൈനോസെബ് ·
ഡൈനോട്ടെർബ് ·
ഡയോക്സാത്തിയോൺ ·
ഡിഫാസിനോൺ ·
ഡൈസൾഫോട്ടോൺ ·
ഡിത്തിയാസനൈൻ അയോഡൈഡ് ·
ഡൈത്തിയോബ്യൂറേറ്റ് ·
എൻഡോസൾഫാൻ ·
എൻഡോത്തിയോൺ ·
എൻഡ്രിൻ ·
എപിക്ലോറോഹൈഡ്രിൻ ·
എർഗോകാൽസിഫെറോൾ ·
എർഗോട്ടാമൈൻ ടാർട്രേറ്റ് ·
എത്തിയോൺ ·
എഥോപ്രോഫോസ് ·
എഥിലീൻ ഫ്ലൂറോഹൈഡ്രിൻ ·
എഥിലീൻ ഓക്സൈഡ് ·
എഥിലീൻനെഡിയമിൻ ·
എഥിലീനൈമിൻ ·
ഈഥൈൽതയോസയനേറ്റ് ·
ഫെനാമിഫോസ് ·
ഫെനിട്രോത്തിയോൺ ·
ഫെൻസൾഫോത്തിയോൺ ·
ഫ്ലൂനെറ്റിൽ ·
ഫ്ലൂമിൻ ·
ഫ്ലൂറിൻ ·
ഫ്ലൂറോഅസെറ്റാമൈഡ് ·
ഫ്ലൂറോഅസെറ്റിക് ആസിഡ് ·
ഫ്ലൂറോഅസെറ്റൈൽ ക്ലോറൈഡ് ·
ഫ്ലൂറൊറാസിൽ ·
ഫോണോഫോസ് ·
ഫോർമാൾഡിഹൈഡ്|ഫോർമാൽഡിഹൈഡ് ·
ഫോർമാൽഡിഹൈഡ് സയനോഹൈഡ്രിൻ ·
ഫോർമെറ്റാനേറ്റ് ഹൈഡ്രോക്ലോറൈഡ് ·
ഫോർമോത്തിയോൺ ·
ഫോംപരാനേറ്റ് ·
ഫോസ്തിയേറ്റാൻ ·
ഫ്യൂബെറിഡാസോൾ ·
ഫ്യൂറാൻ ·
ഗാലിയം ട്രൈക്ലോറൈഡ് ·
ഹെക്സക്ലോറോസൈക്ലോപെന്റാഡിൻ ·
ഹൈഡ്രാസൈൻ ·
ഹൈഡ്രജൻ സയനൈഡ്|ഹൈഡ്രോസയാനിക് ആസിഡ് ·
ഹൈഡ്രജൻ ക്ലോറൈഡ് (വാതകം മാത്രം) ·
ഹൈഡ്രജൻ ഫ്ലൂറൈഡ് ·
ഹൈഡ്രജൻ പെറോക്സൈഡ് ·
ഹൈഡ്രജൻ സെലിനൈഡ് ·
ഹൈഡ്രജൻ സൾഫൈഡ് ·
ഹൈഡ്രോക്വിനോൺ ·
അയൺ പെന്റാകാർബോണൈൽ ·
ഇസോബെൻസാൻ ·
ഐസോഡ്രിൻ ·
ഐസോഫോറോൺ ഡൈസോസയനേറ്റ് ·
ലാക്ടോണിട്രൈൽ ·
ലെപ്റ്റോഫോസ് ·
ലെവിസൈറ്റ് ·
ലിൻഡെയ്ൻ ·
ലിഥിയം ഹൈഡ്രൈഡ് ·
മലോനോനൈട്രൈൽ ·
മെക്ലോറെത്താമൈൻ ·
മെർക്കുറിക് അസറ്റേറ്റ് ·
മെർക്കുറിക് ക്ലോറൈഡ് ·
മെർക്കുറിക് ഓക്സൈഡ് ·
മെത്തക്രോലിൻ ഡൈഅസെറ്റേറ്റ് ·
മെത്തക്രിലിക് അൺഹൈഡ്രൈഡ് ·
മെത്തക്രൈലോനൈട്രൈൽ ·
മെതാക്രിലോയിൽ ക്ലോറൈഡ് ·
മെതാക്രിലോയിൽലോക്സിഈതൈൽ ഐസോസൈനേറ്റ് ·
മെത്തമിഡോഫോസ് ·
മെതനേസൾഫോണിൽ ഫ്ലൂറൈഡ് ·
മെത്തിഡാത്തിയോൺ ·
മെത്തിയോകാർബ് ·
മെത്തോമൈൽ ·
മെത്തോക്സിഈഥൈൽ മെർക്കുറിക് അസറ്റേറ്റ് ·
മെതൈൽ 2-ക്ലോറോഅക്രിലേറ്റ് ·
മെഥൈൽ ബ്രോമൈഡ് ·
മെഥൈൽ ക്ലോറോഫോർമേറ്റ് ·
മെഥൈൽ ഹൈഡ്രാസൈൻ ·
മെഥൈൽ ഐസോസയനേറ്റ് ·
മെഥൈൽ ഐസോത്തിയോസയനേറ്റ് ·
മെഥൈൽ ഫെൻകാപ്റ്റൺ ·
മെഥൈൽ ഫോസ്ഫോണിക് ഡിക്ലോറൈഡ് ·
മെഥൈൽ തയോസയനേറ്റ് ·
മെഥൈൽ വിനൈൽ കീറ്റോൺ ·
മെഥൈമെർകുറിക് ഡിഅസൈനമൈഡ് ·
മെഥൈൽട്രൈക്ലോറോസിലാൻ ·
മെറ്റോൽകാർബ് ·
മെവിൻഫോസ് ·
മെക്സാകാർബേറ്റ് ·
മൈറ്റോമൈസിൻ സി ·
മോണോക്രോടോഫോസ് ·
മസ്സിമോൾ ·
മസ്റ്റാർഡ് ഗ്യാസ് ·
നിക്കൽ കാർബോണൈൽ ·
നിക്കോട്ടിൻ ·
നിക്കോട്ടിൻ|നിക്കോട്ടിൻ സൾഫേറ്റ് ·
നൈട്രിക് ഓക്സൈഡ് ·
നൈട്രോബെൻസീൻ ·
നൈട്രോസൈക്ലോഹെക്സെയ്ൻ ·
നൈട്രജൻ ഡയോക്സൈഡ്|നൈട്രജൻ ഡൈ ഓക്സൈഡ് ·
നോർബോർമൈഡ് ·
ഓർഗനോഹോഡിയം കോംപ്ലക്സ് ·
ഔവാബൈൻ ·
ഓക്സാമൈൽ ·
ഓക്സിഡൈസൾഫോട്ടൺ ·
പാരക്വാട്ട് ·
പാരക്വാട്ട് മെത്തോസൾഫേറ്റ് ·
പാരാത്തിയോൺ ·
പാരാത്തിയോൺ-മെഥൈൽ ·
പാരീസ് ഗ്രീൻ ·
പെന്റബോറേൻ ·
പെന്റഡെസിലാമൈൻ ·
പെരാസെറ്റിക് ആസിഡ് ·
പെർക്ലോറോമെഥൈൽമെർകാപ്റ്റൻ ·
ഫീനോൾ|ഫിനോൾ ·
ഫെനൈൽ ഡൈക്ലോറോഅർസിൻ ·
ഫെനൈൽഹൈഡ്രാസൈൻ ഹൈഡ്രോക്ലോറൈഡ് ·
ഫെനൈൽമെർക്കുറി അസറ്റേറ്റ് ·
ഫെനിൽസിലട്രേൻ ·
ഫെനൈൽത്തിയോറിയ ·
ഫോസ്ഫോളൻ ·
ഫോസ്ജീൻ|ഫോസ്ജെൻ ·
ഫോസ്മെറ്റ് ·
ഫോസ്ഫാമിഡൺ ·
ഫോസ്ഫിൻ ·
ഫോസ്ഫറസ് ·
ഫോസ്ഫറസ് ഓക്സിക്ലോറൈഡ് ·
ഫോസ്ഫറസ് പെന്റക്ലോറൈഡ് ·
ഫോസ്ഫറസ് ട്രൈക്ലോറൈഡ് ·
ഫൈസോസ്റ്റിഗ്മൈൻ ·
ഫൈസോസ്റ്റിഗ്മൈൻ, സാലിസൈലേറ്റ് (1:1) ·
പിക്രോടോക്സിൻ ·
പൈപ്പെരിഡിൻ ·
പ്ലൂട്ടോണിയം ·
പോളോണിയം -210 ·
പൊട്ടാസ്യം ആർസെനൈറ്റ് ·
പൊട്ടാസ്യം സയനൈഡ് ·
പൊട്ടാസ്യം സിൽവർ സയനൈഡ് ·
പ്രോംകാർബ് ·
പ്രൊപാർഗൈൽ ബ്രോമൈഡ് ·
പ്രൊപ്പിയോണിട്രൈൽ ·
പ്രൊപൈലെനിമിൻ ·
പ്രൊപിയോനൈട്രൈൽ, 3-ക്ലോറോ ·
പ്രൊപിയോഫീനോൺ, 4 അമിനോ ·
പ്രൊപൈലെനൈമിൻ ·
പ്രോതോയേറ്റ് ·
പൈറീൻ ·
പൈറിഡിൻ, 4 അമിനോ ·
പൈറിഡിൻ, 4 നൈട്രോ-, 1 ഓക്സൈഡ് ·
പിരിമിനിൽ ·
റെയ്സിൻ ·
സാൽകോമിൻ ·
സരിൻ ·
സെലിനിയസ് ആസിഡ് ·
സെമികാർബാസൈഡ് ഹൈഡ്രോക്ലോറൈഡ് ·
Silane, (4-aminobutyl)diethoxymethyl- ·
സോഡിയം ആഴ്സണേറ്റ് ·
സോഡിയം അസൈഡ് ·
കക്കോഡിലിൿ അമ്ലം|സോഡിയം കക്കോഡിലേറ്റ് ·
സോഡിയം സയനൈഡ് ·
സോഡിയം ഫ്ലൂറോഅസെറ്റേറ്റ് ·
സോഡിയം പെന്റക്ലോറോഫെനേറ്റ് ·
സോഡിയം സെലനേറ്റ് ·
സോഡിയം സെലനൈറ്റ് ·
സ്റ്റാനെയ്ൻ, അസെറ്റോക്സിട്രിഫെനൈൽ- ·
സ്ട്രൈക്നിൻ ·
സ്ട്രൈക്നിൻ സൾഫേറ്റ് ·
സൾഫോടെപ്പ് ·
സൾഫോക്സൈഡ്, 3-ക്ലോറോപ്രോപൈൽ ഒക്റ്റൈൽ ·
സൾഫർ ഡയോക്സൈഡ്|സൾഫർ ഡൈ ഓക്സൈഡ് ·
സൾഫർ ടെട്രാഫ്ളൂറൈഡ് ·
സൾഫർ ട്രയോക്സൈഡ് ·
സൾഫ്യൂരിക് അമ്ലം ·
തബൂൺ ·
ടെല്ലൂറിയം ·
ടെല്ലൂറിയം ഹെക്സാഫ്ളൂറൈഡ് ·
TEPP ·
ടെർബുഫോസ് ·
ടെട്രാ ഈതൈൽ ലെഡ് ·
ടെട്രെതൈൽറ്റിൻ ·
ടെട്രാനിട്രോമെഥെയ്ൻ ·
താലിയം സൾഫേറ്റ് ·
താലസ് കാർബണേറ്റ് ·
താലസ് ക്ലോറൈഡ് ·
താലസ് മലോണേറ്റ് ·
താലസ് സൾഫേറ്റ് ·
തയോകാർബാസൈഡ് ·
തയോഫാനോക്സ് ·
തയോനാസിൻ ·
തയോഫെനോൾ ·
തയോസെമിക്കാർബാസൈഡ് ·
ടൈറ്റാനിയം ടെട്രാക്ലോറൈഡ് ·
ട്രയാമിഫോസ് ·
ട്രയാസോഫോസ് ·
Trichloro(chloromethyl)silane ·
Trichloro(dichlorophenyl)silane ·
ട്രൈക്ലോറോഅസെറ്റൈൽ ക്ലോറൈഡ് ·
ട്രൈക്ലോറോഎഥിൽസിലെയ്ൻ ·
ട്രൈക്ലോറോണേറ്റ് ·
ട്രൈക്ലോറോഫെനൈൽസിലെയ്ൻ ·
ട്രൈതോക്സിസൈലെയ്ൻ ·
ട്രൈമെഥൈൽക്ലോറോസിലെയ്ൻ ·
ട്രൈമെത്തിലിലോപ്രോപെയ്ൻ ഫോസ്ഫൈറ്റ് ·
ട്രൈമെത്തിലിൽറ്റിൻ ക്ലോറൈഡ് ·
ട്രൈഫെനൈൽറ്റിൻ ക്ലോറൈഡ് ·
Tris(2-chloroethyl)amine ·
വാലിനോമൈസിൻ ·
വിനൈൽ അസറ്റേറ്റ് മോണോമർ ·
വാർഫറിൻ ·
വാർഫറിൻ സോഡിയം ·
സൈലീൻ ഡൈക്ലോറൈഡ് ·
സിങ്ക് ഫോസ്ഫൈഡ് ·