NMDA-receptor



Een NMDA-receptor (N-methyl-D-aspartaatreceptor) is een glutamaat-receptor en komt voor in het ionkanaal van zenuwcellen (neuronen). De NMDA-receptor is een van de drie ionotrope glutamaatreceptoren, de andere twee zijn AMPA- en kaïnaatreceptoren. Afhankelijk van de samenstelling van de subeenheid zijn de liganden glutamaat en glycine (of D-serine). De binding van de liganden is echter doorgaans niet voldoende om het ionkanaal te openen, omdat het geblokkeerd kan worden door Mg2+-ionen die alleen worden verwijderd als de zenuwcel voldoende is gedepolariseerd. Het ionkanaal fungeert dus als een “overeenstemmingsdetector” en pas als aan beide voorwaarden is voldaan gaat het ionkanaal open en kunnen positief geladen ionen (kationen) door het celmembraan stromen.[1] Er wordt aangenomen dat de NMDA-receptor erg belangrijk is voor het beheersen van de synaptische plasticiteit en het bevorderen van leer- en geheugenfuncties.[2]
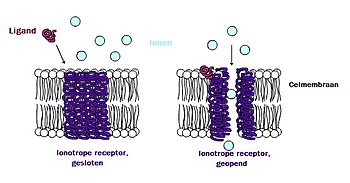
De NMDA-receptor is een ionotrope receptor, wat betekent dat het een eiwit is dat de doorgang van ionen door het celmembraan mogelijk maakt.[3] De NMDA-receptor wordt zo genoemd omdat het agonist-molecuul N-methyl- D-aspartaat (NMDA) zich er selectief aan bindt en niet aan andere glutamaatreceptoren. Activering van NMDA-receptoren resulteert in de opening van het ionkanaal dat niet-selectief is voor kationen met een gecombineerd omkeerpotentaal nabij 0 mV. Terwijl het openen en sluiten van het ionenkanaal voornamelijk wordt geregeld door ligandbinding, is de stroom die door het ionenkanaal vloeit spanningsafhankelijk. Extracellulaire magnesium- (Mg2+) en zink- (Zn2+) ionen, die zich specifiek op de receptor bevinden, kunnen zich binden en voorkomen dat andere kationen door het open ionenkanaal stromen. Een spanningsafhankelijke stroom van natrium- (Na+), calcium- (Ca2+) en kalium- (K+)ionen in en uit van de cel wordt mogelijk gemaakt door de depolarisatie van de cel, die de Mg2+ en Zn2+ ionen uit de porie verdringen en afstoten.[4][5][6][7] Vooral de Ca2+-stroming door de NMDA-receptoren wordt als cruciaal beschouwd bij synaptische plasticiteit, een cellulair mechanisme voor het leren en het geheugen dankzij eiwitten die binden aan en worden geactiveerd door Ca2+-ionen.
De activiteit van de NMDA-receptor wordt geblokkeerd door veel psychoactieve geneesmiddelen zoals fencyclidine (PCP), alcohol (ethanol) en dextromethorfan (DXM). De verdovende en pijnstillende effecten van de geneesmiddelen ketamine en lachgas zijn ook gedeeltelijk te wijten aan hun effecten op het blokkeren van de NMDA-receptoractiviteit. Daarentegen verhoogt overactivering van NMDA-receptor door NMDA-agonisten de cytosolische concentraties van calcium en zink, wat aanzienlijk bijdraagt aan neurale dood, een effect waarvan bekend is dat het wordt voorkomen door cannabinoïden, gemedieerd door activering van de CB1-receptor, waardoor het HINT1-eiwit de giftige effecten van NMDA-receptor-gemedieerde NO-productie en zinkafgifte tegengaat.[8] Naast het voorkomen van door methamfetamine geïnduceerde neurotoxiciteit via remming van de expressie van stikstofoxidesynthase (nNOS) en activatie van astrocyten, wordt ook gezien dat het door methamfetamine geïnduceerde hersenbeschadiging vermindert via respectievelijk CB1-afhankelijke en onafhankelijke mechanismen en remming van door methamfetamine geïnduceerde astrogliose zal waarschijnlijk plaatsvinden via een CB2-receptor-afhankelijk mechanisme voor THC.[9] Sinds 1989 wordt erkend dat memantine een niet-competitieve antagonist van de NMDA-receptor is, die het kanaal van de receptor binnendringt nadat deze is geactiveerd en daardoor de ionenstroom blokkeert.[10][11][12]
Overactivering van de receptor, waardoor een overmatige instroom van Ca2+ ontstaat, kan leiden tot excitotoxiciteit, waarvan wordt aangenomen dat deze betrokken is bij sommige neurodegeneratieve aandoeningen. Het blokkeren van NMDA-receptoren zou daarom in theorie nuttig kunnen zijn bij de behandeling van dergelijke ziekten.[12][13][14][15] De hypoglykemische functie van NMDA-receptoren (als gevolg van glutathiondeficiëntie of andere oorzaken) kan echter betrokken zijn bij aantasting van de synaptische plasticiteit[16] en zou andere negatieve gevolgen kunnen hebben. Het belangrijkste probleem met het gebruik van NMDA-receptor-antagonisten voor neuroprotectie is dat de fysiologische werking van de NMDA-receptor essentieel is voor de normale neuronale functie. Om klinisch bruikbaar te zijn, moeten NMDA-antagonisten overmatige activering blokkeren zonder de normale functies te verstoren. Memantine heeft deze eigenschap.[17]
Geschiedenis
[bewerken | brontekst bewerken]De ontdekking van NMDA-receptoren werd gevolgd door de synthese en studie van N-methyl-D-asparaginezuur (NMDA) in de jaren zestig door Jeff Watkins en collega's. Begin jaren tachtig bleek dat NMDA-receptoren betrokken zijn bij verschillende centrale synaptische banen.[18][19] De selectiviteit van de receptorsubeenheden werd begin jaren negentig ontdekt, wat leidde tot de herkenning van een nieuwe klasse verbindingen die de GRIN2B-subeenheid selectief remmen. Deze bevindingen leidden tot een krachtige campagne in de farmaceutische industrie.[7] Hieruit werd geconcludeerd dat NMDA-receptoren geassocieerd waren met een verscheidenheid aan neurologische aandoeningen zoals epilepsie, ziekte van Parkinson, ziekte van Alzheimer, ziekte van Huntington en andere aandoeningen van het centrale zenuwstelsel.[4]
In 2002 werd door Hilmar Bading en collega's ontdekt dat de cellulaire gevolgen van NMDA-receptorstimulatie afhankelijk zijn van de locatie van de receptor op het neuronale celoppervlak. Synaptische NMDA-receptoren bevorderen genexpressie, neuroplasticiteits gerelateerde gebeurtenissen en verworven neurobescherming. Extra-synaptische NMDA-receptoren bevorderen de signalering van sterfte; ze veroorzaken transcriptionele terminatie, mitochondriale disfunctie en structurele desintegratie. Deze pathologische triade van extra-synaptische NMDA-receptorsignalering vertegenwoordigt een gemeenschappelijk conversiepunt in de etiologie van verschillende acute en chronische neurodegeneratieve aandoeningen. De moleculaire basis voor toxische extra-synaptische NMDA-receptorsignalering werd in 2020 ontdekt door Hilmar Bading en collega's. Extra-synaptische NMDA-receptoren vormen een sterftesignaleringscomplex met TRPM4. NMDAR/TRPM4-interactie-interfaceremmers (ook bekend als interface-remmers) verstoren het NMDAR/TRPM4-complex en ontgiften extra-synaptische NMDA-receptoren.
Een toevallige ontdekking werd gedaan in 1968 toen een vrouw amantadine als griepmedicijn gebruikte en een opmerkelijke remissie van haar Parkinson-symptomen ervoer. Deze ontdekking, gerapporteerd door Scawab et al., was het begin van het door de farmaceutische industrie fabriceren van adamantaanderivaten in de context van ziekten die het centrale zenuwstelsel aantasten.[20] Vóór deze ontdekking werd memantine, een ander adamantaanderivaat, in 1963 gesynthetiseerd door Eli Lilly and Company. Het doel was om een hypoglykemisch medicijn te ontwikkelen, maar het had niet de gewenste werkzaamheid. Pas in 1972 werd een mogelijk therapeutisch belang van memantine voor de behandeling van neurodegeneratieve aandoeningen ontdekt. Sinds 1989 wordt erkend dat memantine een niet-competitieve antagonist van de NMDA-receptor is.
Structuur
[bewerken | brontekst bewerken]
Functionele NMDA-receptoren zijn heterotetrameren die zijn samengesteld uit twee GluN1- en doorgaans twee GluN2-subeenheden.[21] Er zijn één GluN1-, vier GluN2- en twee GluN3-subeenheid-coderende genen. Elk gen kan meer dan één splicingsvariant produceren.
- GluN1 – GRIN1
- GluN2
- GluN3
-
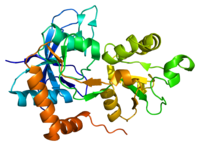
Lintdiagram van GRIN1
-
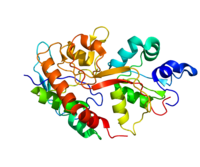
Lintdiagram van GRIN2A
-
Lintdiagram van GRIN2B
Liganden
[bewerken | brontekst bewerken]NMDA-receptor-antagonisten
[bewerken | brontekst bewerken]

Voor het doorlaten van elektrische signalen moet de NMDA-receptor open zijn. Om open te blijven, moeten glutamaat en glycine zich binden aan de NMDA-receptor. Een NMDA-receptor waaraan glycine en glutamaat zijn gebonden en die een open ionkanaal heeft, wordt 'geactiveerd' genoemd.
Chemische stoffen die de NMDA-receptor deactiveren (blokkeren) worden antagonisten genoemd. NMDA-receptor-antagonisten vallen in vier categorieën:
- competitieve antagonisten binden aan de neurotransmitter-glutamaatplaatsen
- glycine-antagonisten binden aan glycineplaatsen
- niet-competitieve antagonisten remmen de binding op de allosterische plaatsen van de NMDA-recptoren
- niet-concurrerende antagonisten binden aan een plaats binnenin het ionkanaal.[24]
Antagonisten van de NMDA-receptor worden gebruikt als verdovingsmiddelen voor dieren en soms mensen, en worden vaak gebruikt als recreatieve drugs vanwege hun hallucinogene eigenschappen, naast hun unieke effecten bij verhoogde doseringen, zoals dissociatie. Wanneer bepaalde NMDA-receptorant-agonisten in grote doses aan knaagdieren worden gegeven, kunnen ze een vorm van hersenbeschadiging veroorzaken die Olney-laesies wordt genoemd. NMDA-receptorantagonisten waarvan is aangetoond dat ze de laesies van Olney veroorzaken, zijn onder meer ketamine, fencyclidine en dextrorfan (een metaboliet van dextromethorfan), evenals enkele NMDA-receptorantagonisten die alleen in onderzoeksomgevingen worden gebruikt. Tot nu toe is het gepubliceerde onderzoek naar de laesies van Olney niet doorslaggevend wat betreft het voorkomen ervan in hersenweefsel van mensen of apen met betrekking tot een toename van de aanwezigheid van NMDA-receptorantagonisten.
Referenties
[bewerken | brontekst bewerken]- ↑ Furukawa H, Singh SK, Mancusso R, Gouaux E (November 2005). Subunit arrangement and function in NMDA receptors. Nature 438 (7065): 185–192. PMID 16281028. DOI: 10.1038/nature04089.
- ↑ Li F, Tsien JZ (July 2009). Memory and the NMDA receptors. The New England Journal of Medicine 361 (3): 302–303. PMID 19605837. PMC 3703758. DOI: 10.1056/NEJMcibr0902052.
- ↑ Moriyoshi K, Masu M, Ishii T, Shigemoto R, Mizuno N, Nakanishi S (November 1991). Molecular cloning and characterization of the rat NMDA receptor. Nature 354 (6348): 31–37. PMID 1834949. DOI: 10.1038/354031a0.
- ↑ a b Dingledine R, Borges K, Bowie D, Traynelis SF (March 1999). The glutamate receptor ion channels. Pharmacological Reviews 51 (1): 7–61. PMID 10049997.
- ↑ Liu Y, Zhang J (October 2000). Recent development in NMDA receptors. Chinese Medical Journal 113 (10): 948–956. PMID 11775847.
- ↑ Cull-Candy S, Brickley S, Farrant M (June 2001). NMDA receptor subunits: diversity, development and disease. Current Opinion in Neurobiology 11 (3): 327–335. PMID 11399431. DOI: 10.1016/S0959-4388(00)00215-4.
- ↑ a b Paoletti P, Neyton J (February 2007). NMDA receptor subunits: function and pharmacology. Current Opinion in Pharmacology 7 (1): 39–47. PMID 17088105. DOI: 10.1016/j.coph.2006.08.011.
- ↑ Sánchez-Blázquez P, Rodríguez-Muñoz M, Vicente-Sánchez A, Garzón J (November 2013). Cannabinoid receptors couple to NMDA receptors to reduce the production of NO and the mobilization of zinc induced by glutamate. Antioxidants & Redox Signaling 19 (15): 1766–1782. PMID 23600761. PMC 3837442. DOI: 10.1089/ars.2012.5100.
- ↑ Castelli MP, Madeddu C, Casti A, Casu A, Casti P, Scherma M, Fattore L, Fadda P, Ennas MG (20 mei 2014). Δ9-tetrahydrocannabinol prevents methamphetamine-induced neurotoxicity. PLOS ONE 9 (5): e98079. PMID 24844285. PMC 4028295. DOI: 10.1371/journal.pone.0098079.
- ↑ Johnson JW, Kotermanski SE (February 2006). Mechanism of action of memantine. Current Opinion in Pharmacology 6 (1): 61–67. PMID 16368266. DOI: 10.1016/j.coph.2005.09.007.
- ↑ Dominguez E, Chin TY, Chen CP, Wu TY (December 2011). Management of moderate to severe Alzheimer's disease: focus on memantine. Taiwanese Journal of Obstetrics & Gynecology 50 (4): 415–423. PMID 22212311. DOI: 10.1016/j.tjog.2011.10.004.
- ↑ a b Chen HS, Lipton SA (June 2006). The chemical biology of clinically tolerated NMDA receptor antagonists. Journal of Neurochemistry 97 (6): 1611–1626. PMID 16805772. DOI: 10.1111/j.1471-4159.2006.03991.x.
- ↑ Kemp JA, McKernan RM (November 2002). NMDA receptor pathways as drug targets. Nature Neuroscience 5 (11): 1039–1042. PMID 12403981. DOI: 10.1038/nn936.
- ↑ Lipton SA (February 2006). Paradigm shift in neuroprotection by NMDA receptor blockade: memantine and beyond. Nature Reviews. Drug Discovery 5 (2): 160–170. PMID 16424917. DOI: 10.1038/nrd1958.
- ↑ Koch HJ, Szecsey A, Haen E (1 January 2004). NMDA-antagonism (memantine): an alternative pharmacological therapeutic principle in Alzheimer's and vascular dementia. Current Pharmaceutical Design 10 (3): 253–259. PMID 14754385. DOI: 10.2174/1381612043386392.
- ↑ Steullet P, Neijt HC, Cuénod M, Do KQ (February 2006). Synaptic plasticity impairment and hypofunction of NMDA receptors induced by glutathione deficit: relevance to schizophrenia. Neuroscience 137 (3): 807–819. PMID 16330153. DOI: 10.1016/j.neuroscience.2005.10.014.
- ↑ Lipton SA (January 2004). Failures and successes of NMDA receptor antagonists: molecular basis for the use of open-channel blockers like memantine in the treatment of acute and chronic neurologic insults. NeuroRx 1 (1): 101–110. PMID 15717010. PMC 534915. DOI: 10.1602/neurorx.1.1.101.
- ↑ Yamakura T, Shimoji K (October 1999). Subunit- and site-specific pharmacology of the NMDA receptor channel. Progress in Neurobiology 59 (3): 279–298. PMID 10465381. DOI: 10.1016/S0301-0082(99)00007-6.
- ↑ Watkins JC, Jane DE (January 2006). The glutamate story. British Journal of Pharmacology 147 (S1): S100–S108. PMID 16402093. PMC 1760733. DOI: 10.1038/sj.bjp.0706444.
- ↑ Wanka L, Iqbal K, Schreiner PR (May 2013). The lipophilic bullet hits the targets: medicinal chemistry of adamantane derivatives. Chemical Reviews 113 (5): 3516–3604. PMID 23432396. PMC 3650105. DOI: 10.1021/cr100264t.
- ↑ Salussolia CL, Prodromou ML, Borker P, Wollmuth LP (August 2011). Arrangement of subunits in functional NMDA receptors. The Journal of Neuroscience 31 (31): 11295–11304. PMID 21813689. PMC 3207322. DOI: 10.1523/JNEUROSCI.5612-10.2011.
- ↑ Laube B, Hirai H, Sturgess M, Betz H, Kuhse J (March 1997). Molecular determinants of agonist discrimination by NMDA receptor subunits: analysis of the glutamate binding site on the NR2B subunit. Neuron 18 (3): 493–503. PMID 9115742. DOI: 10.1016/S0896-6273(00)81249-0.
- ↑ Anson LC, Chen PE, Wyllie DJ, Colquhoun D, Schoepfer R (January 1998). Identification of amino acid residues of the NR2A subunit that control glutamate potency in recombinant NR1/NR2A NMDA receptors. The Journal of Neuroscience 18 (2): 581–589. PMID 9425000. PMC 6792534. DOI: 10.1523/JNEUROSCI.18-02-00581.1998.
- ↑ a b CNS Neuroprotection. Springer, New York (2002), "Blocking Excitotoxicity", 3–36.