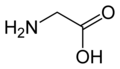
Glicyna
| |||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||||||||||||
| Wzór sumaryczny |
C2H5NO2 | ||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Inne wzory |
H | ||||||||||||||||||||||||||||||||||
| Masa molowa |
75,07 g/mol | ||||||||||||||||||||||||||||||||||
| Wygląd |
biały lub prawie biały, krystaliczny proszek[1], o słodkawym smaku[2] | ||||||||||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||||||||||
| Numer CAS |
56-40-6 | ||||||||||||||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||||||||||||||
| DrugBank | |||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||||||||
| Pochodne | |||||||||||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||||||||||||
| Klasyfikacja medyczna | |||||||||||||||||||||||||||||||||||
| ATC | |||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||
Glicyna (łac. acidum aminoaceticum), skr. Gly, G – organiczny związek chemiczny, najprostszy spośród 20 standardowych aminokwasów białkowych, jedyny niebędący czynny optycznie[2]. Za jej pojawienie się w łańcuchu polipeptydowym odpowiada obecność kodonów GGU, GGC, GGA lub GGG w łańcuchu mRNA.
Można ją otrzymać sztucznie w reakcji kwasu chlorooctowego z amoniakiem[2].
- ClCH2COOH + 2NH3 → H2NCH2COOH + NH4Cl
Struktura i właściwości
[edytuj | edytuj kod]Glicyna posiada najmniejszą resztę aminokwasową, z jednym tylko atomem wodoru w łańcuchu bocznym. Ze względu na to, że z atomem węgla α związane są dwa atomy wodoru, glicyna – w przeciwieństwie do innych aminokwasów – nie jest optycznie czynna. Glicyna zalicza się do grupy aminokwasów niepolarnych alifatycznych.
W trakcie ewolucji dywergentnej (rozbieżnej) reszty glicyny zmieniają się znacznie rzadziej niż pozostałych aminokwasów, a gdy już ulegają mutacji w białkach homologicznych, to na takie reszty jak alanina, seryna, kwas asparaginowy lub asparagina. Ta konserwatywność w występowaniu glicyny wiąże się z jej niewielkimi rozmiarami – zmiana tego aminokwasu na inny, z większym łańcuchem bocznym, mogłaby zaburzyć strukturę przestrzenną białka i pozbawić to białko jego funkcji biologicznej.
Glicyna stanowi średnio około 7,2% reszt aminokwasowych występujących w białkach[6]. Wyjątkiem jest kolagen, w którym glicyna stanowi blisko jedną trzecią wszystkich budujących go aminokwasów.
Glicyna jest aminokwasem endogennym.
Objętość van der Waalsa 48 ų.
Funkcja fizjologiczna
[edytuj | edytuj kod]
[Na schemacie nie pokazano atomów wodoru znajdujących się przy atomach węgla C2, C6 i C9 w pierścieniu pirymidynowym]
- Glicyna jako samodzielny aminokwas występuje przede wszystkim w roli przekaźnika w ośrodkowym układzie nerwowym (CNS). Działa jako hamujący przekaźnik receptorów glicynowych, a ponadto jako koagonista kluczowy do aktywacji receptorów NMDA. Stężenie glicyny w CNS jest wyższe w rdzeniu przedłużonym, moście oraz rdzeniu kręgowym, natomiast niższe w półkulach mózgowych oraz móżdżku.
- W peroksysomach hepatocytów glicyna ulega sprzęgnięciu z pierwotnymi kwasami żółciowymi, tworząc w ten sposób sole żółciowe.
- Glicyna bierze udział w biosyntezie puryn de novo, w trakcie której zostaje wbudowana do pierścienia nukleotydowego, będąc źródłem węgli C4 i C5 oraz azotu N7 w tym pierścieniu.
- LD50 dla glicyny wynosi 7930 mg/kg (szczury, podawana ustnie), natomiast śmierć następuje zazwyczaj na skutek wzmożonej pobudliwości.
Biosynteza
[edytuj | edytuj kod]
Ludzki organizm potrafi syntetyzować glicynę, dlatego nazywa się ją aminokwasem endogennym. Glicyna może być produkowana: z glioksalanu i glutaminianu przez aminotransferazę glutaminianową; z alaniny przez aminotransferazę alaninową. Ważnym sposobem syntezy glicyny u ssaków jest także synteza z choliny oraz seryny.
Degradacja glicyny
[edytuj | edytuj kod]
Glicyna ulega degradacji na drodze trzech szlaków metabolicznych.
- Glicyna może ulec przekształceniu w serynę. Reakcję katalizuje hydroksymetylotransferaza serynowa, a koenzymami reakcji są tetrahydrofolian oraz fosforan pirydoksalu.
- Degradacja glicyny może zachodzić także w wątrobie za pomocą mitochondrialnego kompleksu syntazy glicynowej, który rozkłada glicynę na dwutlenek węgla i jon amonowy, przy okazji tworząc N5,N10-metylenotetrahydrofolian. Kofaktorem tego procesu jest fosforan pirydoksalu. Ta ścieżka metaboliczna ma olbrzymie znaczenie dla ssaków, a jej zaburzenia mogą prowadzić do hiperglicynemii.
- Trzecim sposobem degradacji glicyny jest utlenienie przez oksydazę D-aminokwasów. Glicyna zostaje przekształcona do glioksalanu, który z kolei jest utleniany w NAD+-zależnej reakcji do szczawianu.
Ponadto glicyna ulega licznym przemianom w inne metabolity, co zostało opisane w podrozdziale dotyczącym jej funkcji.
Choroby związane z przemianami glicyny
[edytuj | edytuj kod]Z metabolizmem glicyny związane są następujące schorzenia:
- Glicynuria – wynika z zaburzeń reabsorpcji glicyny w kanalikach nerkowych i polega na wydalaniu większych niż normalnie ilości tego aminokwasu.
- Pierwotna hiperoksaluria – jest to zaburzenie katabolizmu glioksalanu, który powstaje przez deaminację glicyny. Następujące po tym utlenienie glioksalanu do szczawianu skutkuje kamicą moczową oraz wapnicą nerek, a także może prowadzić do przedwczesnych zgonów na skutek niewydolności nerek lub nadciśnienia.
- Nieketonowa hiperglicynemia – choroba genetyczna powodująca nagromadzenie się glicyny we krwi oraz płynie mózgowo-rdzeniowym.
Zastosowanie w lecznictwie
[edytuj | edytuj kod]Glicyna jest wykorzystywana do zwiększania skuteczności leków przeciwpsychotycznych zawierających kwas glutaminowy. Choć sama w sobie nie ma działania psychotropowego, to jednak wzmacnia efekty działania glutaminianu w mózgu (zgodnie z hipotezą glutaminową). Przyłącza się do receptora NMDA wraz z glutaminianem i pokonuje barierę krew-mózg[7].
Występowanie glicyny w przestrzeni międzygwiazdowej
[edytuj | edytuj kod]W roku 1994 grupa badaczy z University of Illinois pod kierownictwem Lewisa Snydera ogłosiła wstępnie odkrycie glicyny w przestrzeni międzygwiazdowej, jednak późniejsze badania nie potwierdziły ich przypuszczeń[8].
Dziewięć lat później, w 2003 roku, Yi-Jehng Kuan z National Taiwan Normal University wraz ze Steve’em Charlneyem z NASA ponowili to doniesienie. Badacze monitorowali fale radiowe pod kątem obecności linii spektralnych charakterystycznych dla glicyny, których zarejestrowali w sumie 27. Kuan i Charlney wysunęli hipotezę, że glicyna międzygwiazdowa powstała z prostych cząsteczek organicznych uwięzionych w lodzie na skutek ekspozycji na nadfiolet[9].
W roku 2004 Snyder wraz ze współpracownikami opublikowali pracę, w której próbowali określić obiektywne kryterium, które powinny spełniać rejestrowane linie spektralne, aby można było mówić o potwierdzonym odkryciu glicyny w przestrzeni międzygwiazdowej. Uznali jednocześnie, że żaden z rezultatów uzyskanych przez grupę Kuana nie spełnia tego kryterium[10].
W roku 2009 dzięki misji NASA Stardust ostatecznie potwierdzono występowanie glicyny w przestrzeni kosmicznej pobierając próbki z komety Wild 2[11].
W 2016 roku ogłoszono, że sonda Rosetta odkryła glicynę w komie komety 67P/Czuriumow-Gierasimienko podczas pomiarów za pomocą spektrometru masowego ROSINA w latach 2014–2015.[12]
Tzw. glicyna fotograficzna
[edytuj | edytuj kod]W fotografii terminem „glicyna” określa się typ wywoływacza fotograficznego zawierającego pochodną glicyny, N-(4-hydroksyfenylo)glicynę.
Przypisy
[edytuj | edytuj kod]- ↑ a b Farmakopea Polska VIII, Polskie Towarzystwo Farmaceutyczne, Warszawa: Urząd Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych, 2008, s. 3491, ISBN 978-83-88157-53-0.
- ↑ a b c Podręczny słownik chemiczny, Romuald Hassa (red.), Janusz Mrzigod (red.), Janusz Nowakowski (red.), Katowice: Videograf II, 2004, s. 147–148, ISBN 83-7183-240-0.
- ↑ a b c d e Glicyna. [martwy link] The Chemical Database. Wydział Chemii Uniwersytetu w Akronie. [dostęp 2012-09-01]. (ang.).[niewiarygodne źródło?]
- ↑ a b Glycine, [w:] ChemIDplus [online], United States National Library of Medicine [dostęp 2012-09-01] (ang.).
- ↑ Glycine, [w:] DrugBank [online], University of Alberta, DB00145 (ang.).
- ↑ Nelson D., Cox M., Lehninger Principles of Biochemistry, wyd. 4, 2005, W.H. Freeman & Co.
- ↑ James Kalat, Biologiczne podstawy psychologii, 2004.
- ↑ Rachel Nowak: Amino acid found in deep space. [w:] New Scientist [on-line]. newscientist.com, 2002-07-18. [dostęp 2016-10-16].
- ↑
 Yi-Jehng Kuan and Steven B. Charnley and Hui-Chun Huang and Wei-Ling Tseng and Zbigniew Kisiel. Interstellar Glycine. „The Astrophysical Journal”. 593 (2), s. 848–867, 2003. DOI: 10.1086/375637.
Yi-Jehng Kuan and Steven B. Charnley and Hui-Chun Huang and Wei-Ling Tseng and Zbigniew Kisiel. Interstellar Glycine. „The Astrophysical Journal”. 593 (2), s. 848–867, 2003. DOI: 10.1086/375637.
- ↑
 L. E. Snyder and F. J. Lovas and J.M. Hollis and D. N. Friedel and P. R. Jewell and A. Remijan and V. V. Ilyushin and E. A. A Rigorous Attempt to Verify Interstellar Glycine. „The Astrophysical Journal”. 619 (2), s. 914–930, 2005. DOI: 10.1086/426677.
L. E. Snyder and F. J. Lovas and J.M. Hollis and D. N. Friedel and P. R. Jewell and A. Remijan and V. V. Ilyushin and E. A. A Rigorous Attempt to Verify Interstellar Glycine. „The Astrophysical Journal”. 619 (2), s. 914–930, 2005. DOI: 10.1086/426677.
- ↑ Maggie McKee: Found: first amino acid on a comet. [w:] New Scientist [on-line]. newscientist.com, 2009-08-17. [dostęp 2016-10-16].
- ↑
 Kathrin Altwegg, Hans Balsiger, Akiva Bar-Nun, Jean-Jacques Berthelier, Andre Bieler. Prebiotic chemicals–amino acid and phosphorus–in the coma of comet 67P/Churyumov-Gerasimenko. „Science Advances”. 2 (5), s. e1600285, 2016. DOI: 10.1126/sciadv.1600285.
Kathrin Altwegg, Hans Balsiger, Akiva Bar-Nun, Jean-Jacques Berthelier, Andre Bieler. Prebiotic chemicals–amino acid and phosphorus–in the coma of comet 67P/Churyumov-Gerasimenko. „Science Advances”. 2 (5), s. e1600285, 2016. DOI: 10.1126/sciadv.1600285.
Bibliografia
[edytuj | edytuj kod]- Nelson D., Cox M., Lehninger Principles of Biochemistry, wyd. 4, 2005, W.H. Freeman & Co.
- Murray R.K. et al., Harper’s Ilustrated Biochemistry, wyd. 26, 2003, Lange Medical Books.
- Encyclopedia of Biological Chemistry, Lenarz W.J., Lane M.D. (red.), 2004, Elsevier.
- Berg J.M., Tymoczko J.L., Stryer L., Biochemistry, wyd. 5, 2002, W.H. Freeman & Co.
Linki zewnętrzne
[edytuj | edytuj kod]- Szlaki metaboliczne glicyny – baza danych Uniwersytetu w Kyoto
- Szlaki metaboliczne glicyny 2 – baza szlaków metabolicznych MetaCyc