Fosforasta kiselina
| Fosforasta kiselina | |||
|---|---|---|---|
| |||
| |||
| IUPAC ime |
| ||
| Drugi nazivi | fosforasta kiselina | ||
| Identifikacija | |||
| CAS registarski broj | 13598-36-2 | ||
| ChemSpider[1] | 10449259 | ||
| KEGG[2] | |||
| MeSH | |||
| ChEBI | 44976 | ||
| RTECS registarski broj toksičnosti | SZ6400000 | ||
| Jmol-3D slike | Slika 1 | ||
| |||
| |||
| Svojstva | |||
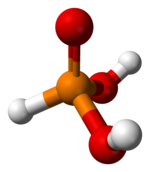
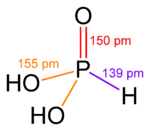
| Molekulska formula | H3PO3 | ||
| Molarna masa | 82.00 g/mol | ||
| Agregatno stanje | bezbojna čvrsta supstanca | ||
| Gustina | 1.65 g/cm3 | ||
| Tačka topljenja |
70.1 °C | ||
| Tačka ključanja |
razlaže se | ||
| Rastvorljivost u vodi | meša se | ||
| Struktura | |||
| Oblik molekula (orbitale i hibridizacija) | tetraedar | ||
| Opasnost | |||
| Opasnost u toku rada | iritira kožu | ||
| NFPA 704 | |||
| R-oznake | R22-R35 | ||
| S-oznake | S26-S36/37/39-S45 | ||
| Srodna jedinjenja | |||
| Сродна једињења | H3PO4 (PO(OH)3) H3PO2 (H2PO(OH)) | ||
|
| |||
| Infobox references | |||
Fosforasta (fosfitna) kiselina, H2PHO3, je bezbojna kristalna supstanca koja se dobro rastvara u vodi. Pripada grupi diprotonskih kiselina (iako sadrži 3 vodonikova atoma), i kao takva gradi dva različita tipa soli: fosfite i hidrogenfosfite.[3]
Pri zagrevanju se iz 4 mola ove kiseline dobijaju fosfin i fosforna kiselina. Fosforasta kiselina ima izaraženije redukcione osobine.
Fosfiti natrijuma, NaHPHO3 i Na2PHO3 mogu da se koriste kao antiseptici. U reakciji sa slabim baza pokazuje kiselu reakciju.ki
- ↑ Hettne KM, Williams AJ, van Mulligen EM, Kleinjans J, Tkachenko V, Kors JA. (2010). „Automatic vs. manual curation of a multi-source chemical dictionary: the impact on text mining”. J Cheminform 2 (1): 3. DOI:10.1186/1758-2946-2-3. PMID 20331846.
- ↑ Joanne Wixon, Douglas Kell (2000). „Website Review: The Kyoto Encyclopedia of Genes and Genomes — KEGG”. Yeast 17 (1): 48–55. DOI:10.1002/(SICI)1097-0061(200004)17:1<48::AID-YEA2>3.0.CO;2-H.
- ↑ Lide David R., ur. (2006). CRC Handbook of Chemistry and Physics (87th izd.). Boca Raton, FL: CRC Press. 0-8493-0487-3.

