Selenova kiselina
| Selenova kiselina | |||
|---|---|---|---|
 |
 | ||
| IUPAC ime |
| ||
| Drugi nazivi | Selenova kiselina | ||
| Identifikacija | |||
| CAS registarski broj | 7783-08-6 | ||
| PubChem[1][2] | 1089 | ||
| ChemSpider[3] | 1058 | ||
| KEGG[4] | |||
| ChEBI | 18170 | ||
| RTECS registarski broj toksičnosti | VS6575000 | ||
| Jmol-3D slike | Slika 1 | ||
| |||
| |||
| Svojstva | |||
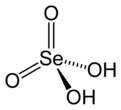
| Molekulska formula | H2SeO4 | ||
| Molarna masa | 144.9734 g/mol | ||
| Agregatno stanje | Bezbojni delikvescentni kristali | ||
| Gustina | 2.95 g/cm3, čvrsto stanje | ||
| Tačka topljenja |
58 °C (331 K) | ||
| Tačka ključanja |
260 °C (533 K) (razlaže se) | ||
| Rastvorljivost u vodi | 130 g/100 mL (30 °C) | ||
| pKa | slična sa H2SO4 | ||
| Indeks prelamanja (nD) | 1.5174 (D-linija, 20 °C) | ||
| Struktura | |||
| Oblik molekula (orbitale i hibridizacija) | tetraedralna na Se | ||
| Opasnost | |||
| Opasnost u toku rada | Korozivna, visoko toksična | ||
| NFPA 704 | |||
| R-oznake | 23/25-33-50/53 | ||
| S-oznake | 20/21-28-45-60-61 | ||
| Srodna jedinjenja | |||
| Drugi anjoni | selenasta kiselina vodonik selenid | ||
| Drugi katjoni | natrijum selenat | ||
| Srodna jedinjenja | sumporna kiselina selen dioksid selen trioksid telurna kiselina | ||
|
Ukoliko nije drugačije napomenuto, podaci se odnose na standardno stanje (25 °C, 100 kPa) materijala | |||
| Infobox references | |||
Selenova kiselina je hemijsko jedinjenje sa formulom H2SeO4. Ona je oksokiselina selena, i njena struktura se preciznije opisuje sa (HO)2SeO2.
Kao što je predviđeno VSEPR teorijom, selenski center je tetraedralan, sa Se–O dužinom veze od 161 pm.[5] U čvrstom stanju, njeni kristali imaju rombičnu strukturu.[6]
Usled nestabilnosti selen trioksida, nije praktično sintetisati selenovu kiselinu rastvaranjem selen trioksida u vodi, poput načina na koji se sintetiše sumporne kiseline rastvaranjem sumpor trioksida.[5] Umesto toga ona se priprema oksidacijom jedinjenja selena na nižim oksidacionim stanjima.
Selenova kiselina se može pripremiti oksidacijom selen dioksida koristeći vodonik peroksid:
- SeO2 + H2O2 → H2SeO4
Da bi se dobila anhidratna kiselina kao kristalni materijal, rezultirajući rastvor se uparava na temperaturama ispod 140 °C u vakuumu.[7]
Selenova kiselina se isto tako može pripremiti oksidacijom selenaste kiseline (H2SeO3) halogenima, kao što su hlor ili brom, ili sa kalijum permanganatom.[8] Korišćenje hlora ili broma kao oksidicionih agensa proizvodi hlorovodoničnu ili bromovodoničnu kiselinu kao sporedni proizvod. Ovu kiselinu je neophodno ukloniti iz rastvora pošto ona može da redukuje selenovu kiselinu do selenaste kiseline.[9]
Još jedan metod pripreme selenove kiseline je oksidacija elementarnog selena u vodenoj suspenziji hlora:[8]
- Se + 4 H2O + 3 Cl2 → H2SeO4 + 6 HCl
Poput sumporne kiseline, selenova kiselina je jaka kiselina koja je higroskopna i ekstremno rastvorna u vodi. Koncentrovani rastvori su viskozni. Kristalni mono- i di-hidrati su poznati.[8] Monohidrat se topi na 26 °C, a dihidrat na −51.7 °C.[5]
Selenova kiselina se razlaže na oko 200 °C:[8]
- 2 H2SeO4 → 2 H2SeO3 + O2
- ↑ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today 15 (23-24): 1052-7. DOI:10.1016/j.drudis.2010.10.003. PMID 20970519.
- ↑ Evan E. Bolton, Yanli Wang, Paul A. Thiessen, Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry 4: 217-241. DOI:10.1016/S1574-1400(08)00012-1.
- ↑ Hettne KM, Williams AJ, van Mulligen EM, Kleinjans J, Tkachenko V, Kors JA. (2010). „Automatic vs. manual curation of a multi-source chemical dictionary: the impact on text mining”. J Cheminform 2 (1): 3. DOI:10.1186/1758-2946-2-3. PMID 20331846.
- ↑ Joanne Wixon, Douglas Kell (2000). „Website Review: The Kyoto Encyclopedia of Genes and Genomes — KEGG”. Yeast 17 (1): 48–55. DOI:10.1002/(SICI)1097-0061(200004)17:1<48::AID-YEA2>3.0.CO;2-H.
- ↑ 5,0 5,1 5,2 Don M. Yost (2007). Systematic Inorganic Chemistry. Read Books. str. 343–346. ISBN 1406773026.
- ↑ Mathias S. Wickleder (2007). Francesco A. Devillanova. ur. Handbook of chalcogen chemistry: new perspectives in sulfur, selenium and tellurium. Royal Society of Chemistry. str. 353. ISBN 0854043667.
- ↑ Seppelt, K. “Selenoyl difluoride” Inorganic Syntheses, 1980, volume XX, pp. 36-38. ISBN 0-471-07715-1. The report describes the synthesis of selenic acid.
- ↑ 8,0 8,1 8,2 8,3 Anil Kumar De (2003). A Text Book of Inorganic Chemistry. New Age International. str. 543–545. ISBN 8122413846.
- ↑ V. Lenher, C. H. Kao (June 1925). „The preparation of selenic acid and of certain selenates”. Journal of the American Chemical Society 47 (6): 1521–1522. DOI:10.1021/ja01683a005.


