Морфолин
| |||
| |||
| Називи | |||
|---|---|---|---|
| IUPAC назив
morfolin
| |||
| Други називи
Диетиленимид Оксид
1,4-оксазинан тетрахидро-1,4-оксазин | |||
| Идентификација | |||
3Д модел (Jmol)
|
|||
| ECHA InfoCard | 100.003.469 | ||
| RTECS | QД6475000 | ||
| |||
| Својства | |||
| C4H9NO | |||
| Моларна маса | 87,1 g/mol | ||
| Агрегатно стање | Безбојна течност | ||
| Густина | 1,007 g/cm3 | ||
| Тачка топљења | −5 °C (23 °F; 268 K) | ||
| Тачка кључања | 129 °C (264 °F; 402 K) | ||
| meša se | |||
| Kiselost (pKa) | 8.36[1] | ||
| Opasnosti | |||
| Opasnost u toku rada | Zapaljiv, korozivan | ||
| Bezbednost prilikom rukovanja | Oxford MSDS | ||
| R-oznake | R10 R20/21/22 R34 | ||
| S-oznake | (S1/2) S23 S36 S45 | ||
| NFPA 704 | |||
| Tačka paljenja | 31 °C | ||
| 275 °Ц (527 °Ф; 548 К) | |||
Уколико није другачије напоменуто, подаци се односе на стандардно стање материјала (на 25 °C [77 °F], 100 kPa). | |||
| Референце инфокутије | |||
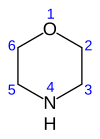
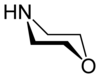
Морфолин је органско хемијско једињење са хемијском формулом O (CH2CH2)2NH.[2] Ово хетероциклично једињење, садржи аминску и етарску функционалну групу. Аминска група даје морфолину базни карактер. Његова коњугована киселина се назива морфолинијум. Неутрализацијин морфолина са хлороводоничном киселином настаје со морфолинијум хлорид.
Производња
[уреди | уреди извор]Морфолин се може производити дехидратацијом диетаноламина сумпорном киселином:[3]
Употреба
[уреди | уреди извор]Индустријске примене
[уреди | уреди извор]Морфолин се често користи као адитив, у малим (делови на милион) концентрацијама, за pH подешавање у парним системима фосилних и нуклеарних електрана. Морфолин се користи зато што је његова испарљивост приближно иста са водом, тако да кад је додат у воду његова концентрација је равномерно распоређена између течне и гасовите фазе. Услед тога он равномерно подешава pH вредности у целој парној инсталацији, чиме се спречава корозија. Морфолин се често користи заједно са ниским концентрацијама хидразина или амонијака као средство за свеобухватани хемијски треатман против корозије за парне системе таквих постројења. Морфолин се споро разлаже у одсуству кисеоника на високим температурама и притиску тих система.
Органска синтеза
[уреди | уреди извор]Морфолин подлеже већини хемијских реакција типичних за друге секундарне амине, мада услед присуства етарског кисеоника долази до смањења електронске густине на атому азота, због чега је он мање нуклеофилан (и мање базан) него структурно слични секундарни амини, као што је пиперидин. Из тог разлога, он формира стабилни хлорамин.[4]
Он се често користи за генерисање енамина.[5]
Морфолин је у широкој употреби у органској синтези. На пример, он је градивни блок у припреми антибиотика линезолида и антитуморског лека гефитиниба (Iressa).
U naučnim istraživanjima i industriji, morfolin je zbog svoje niske cene i polarnost uobičajeni rastvarač za hemijske reakcije.
Reference
[уреди | уреди извор]- ^ Hall, H.K., J. Am. Chem. Soc., 1957, 79, 5441.
- ^ National Institute for Occupational Safety and Health (2000). „Morpholine”. International Chemical Safety Cards. Архивирано из оригинала 25. 12. 2007. г. Приступљено 5. 11. 2005.
- ^ Klaus Weissermel; Hans-Jürgen Arpe; Charlet R. Lindley; Stephen Hawkins (2003). „Chap. 7. Oxidation Products of Ethylene”. Industrial Organic Chemistry. Wiley-VCH. стр. 159—161. ISBN 978-3-527-30578-0.
- ^ Lindsay Smith, J. R.; McKeer, L. C.; Taylor, J. M. (1993). „4-Chlorination of Electron-Rich Benzenoid Compounds: 2,4-Dichloromethoxybenzene”. Org. Synth.; Coll. Vol., 8, стр. 167
- ^ Noyori, R.; Yokoyama, K.; Hayakawa, Y. (1988). „Cyclopentenones from α,α'-Dibromoketones and Enamines: 2,5-Dimethyl-3-Phenyl-2-Cyclopenten-1-one”. Org. Synth.; Coll. Vol., 6, стр. 520
Literatura
[уреди | уреди извор]- Klaus Weissermel; Hans-Jürgen Arpe; Charlet R. Lindley; Stephen Hawkins (2003). „Chap. 7. Oxidation Products of Ethylene”. Industrial Organic Chemistry. Wiley-VCH. стр. 159—161. ISBN 978-3-527-30578-0.