0 évaluation0% ont trouvé ce document utile (0 vote)
85 vuesTP 1
TP 1
Transféré par
Nasro DjeCe document présente les lois des gaz parfaits, notamment les lois de Boyle-Mariotte, Gay-Lussac et Charles. Il définit les gaz parfaits, l'équation d'état des gaz parfaits et donne les détails des trois lois mentionnées.
Droits d'auteur :
© All Rights Reserved
Formats disponibles
Téléchargez comme DOCX, PDF, TXT ou lisez en ligne sur Scribd
TP 1
TP 1
Transféré par
Nasro Dje0 évaluation0% ont trouvé ce document utile (0 vote)
85 vues1 pageCe document présente les lois des gaz parfaits, notamment les lois de Boyle-Mariotte, Gay-Lussac et Charles. Il définit les gaz parfaits, l'équation d'état des gaz parfaits et donne les détails des trois lois mentionnées.
Titre original
tp 1
Copyright
© © All Rights Reserved
Formats disponibles
DOCX, PDF, TXT ou lisez en ligne sur Scribd
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Ce document présente les lois des gaz parfaits, notamment les lois de Boyle-Mariotte, Gay-Lussac et Charles. Il définit les gaz parfaits, l'équation d'état des gaz parfaits et donne les détails des trois lois mentionnées.
Droits d'auteur :
© All Rights Reserved
Formats disponibles
Téléchargez comme DOCX, PDF, TXT ou lisez en ligne sur Scribd
Télécharger au format docx, pdf ou txt
0 évaluation0% ont trouvé ce document utile (0 vote)
85 vues1 pageTP 1
TP 1
Transféré par
Nasro DjeCe document présente les lois des gaz parfaits, notamment les lois de Boyle-Mariotte, Gay-Lussac et Charles. Il définit les gaz parfaits, l'équation d'état des gaz parfaits et donne les détails des trois lois mentionnées.
Droits d'auteur :
© All Rights Reserved
Formats disponibles
Téléchargez comme DOCX, PDF, TXT ou lisez en ligne sur Scribd
Télécharger au format docx, pdf ou txt
Vous êtes sur la page 1sur 1
I.
Ce quetu vas faire pensantce TP :
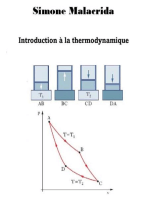
1- la loi des gaz parfaits : loi de Boyle-Mariotte, loi de Gay Lussac ,loi de Charles.
2- Appliquerceslois à des casconcrets.
3- des mesures de volumes, de températures et de pressions.
Partie théorique
II. Définitions :
-gaz parfaitest un modèlethermodynamiquedécrivant le comportement des gazréels à
bassepressionalors on exclut les variables électriques et magnétiques, du coup l’état du gaz ne
dépend plus que de cesparamètres : la pression (P), le volume (V), et la température (T).
-L'équationd'étatdugaz parfaitest : PV = n RT
-n le nombre de moles qui réagit
-R la constante des gaz parfaits = 8,314J/mol.k
-Ten Kelvin
- V en m3
-LES GAZ PARFAITS VÉRIFIENT LES LOIS SUIVANTES :
-La loi de Boyle-Mariotte PV = constante avec T et n constants
-La loi de Gay- Lussac V/T = constante avec P et n constants
-La loi de Charles P/T = constante avec V et n constants
-La loid’Avogadro V/n = constante avec P et T constants
Dansce TP, on ne vérifieraseulementque la loi de Boyle-Mariotte et la loi de Gay-Lussac et loi de
Charles.
Rappels :
Température : °C + 273,15 → K
Volume : 1 mL → 1 * 10-6 m³
Pression : 1 mbar →100 Pa
-Loi de Boyle-Mariotte :(loi de compressibilité des gaz)
Boyle et Mariotteétablissentqu’àtempérature constante, le produit de la pression ( ) par
le volume (V) d’une masse de gaz invariable estune constant. :P×V=cte
Cette relation constituel’équationcaractéristiqued’une transformation isotherme d’un gaz
parfait.
-Loi-Loi de Gay-Lussac:(dilatation des gaz à pression constante)
A pression constante, le volume d’une masse invariable de gazestproportionnel à sa
températureabsolue :V/T = cte
Cette relation estl’équationcaractéristiqued’une transformation isobare d’un gaz parfait.
-loi de Charles : (variation de la pression à volume constant)
A volume constant, la pressiond’une masse invariable de gazestproportionnelle à sa
températureabsolue : P/T=cte
Cette relation estl’équationcaractéristiqued’une transformation isochore d’un gaz parfait.
Vous aimerez peut-être aussi
- TP N 1 Pompes Et CompresseursDocument17 pagesTP N 1 Pompes Et CompresseursNasro DjePas encore d'évaluation
- Équation D'état D'un Gaz ParfaitDocument11 pagesÉquation D'état D'un Gaz ParfaitHassan Ben Touda81% (16)
- TD - T3 ThermodynDocument9 pagesTD - T3 Thermodyntbourne15Pas encore d'évaluation
- I. Ce Que Tu Vas Faire Pensant Ce TP:: - L'équation D'état Du Gaz Parfait Est: PV N RTDocument1 pageI. Ce Que Tu Vas Faire Pensant Ce TP:: - L'équation D'état Du Gaz Parfait Est: PV N RTNasro DjePas encore d'évaluation
- Exp01 - MariotteDocument8 pagesExp01 - Mariottei k0% (1)
- Cours LOIS CARACTERISTIQUES DES GAZ PARFAITSDocument8 pagesCours LOIS CARACTERISTIQUES DES GAZ PARFAITSThierry roland UmPas encore d'évaluation
- Lois Charles Gay LussacDocument23 pagesLois Charles Gay LussacDENARNAUD LAURENTPas encore d'évaluation
- Cours Etat Physique (Gaz) CH3Document26 pagesCours Etat Physique (Gaz) CH3Aziz Ben GandiaPas encore d'évaluation
- 3chimie Générale PR - El MrabetDocument53 pages3chimie Générale PR - El MrabetFouad BenallalPas encore d'évaluation
- Cours 12 Les Gaz ParfaitsDocument1 pageCours 12 Les Gaz ParfaitsBeatrice Florin100% (3)
- Aero Chimie Gaz ParfaitsDocument19 pagesAero Chimie Gaz ParfaitsMohamed El HajjamPas encore d'évaluation
- BC 1 LoidesgazDocument4 pagesBC 1 LoidesgazÄness BŝŁm Řm EverPas encore d'évaluation
- 3.equation Détat Etudiants CorrigéDocument6 pages3.equation Détat Etudiants Corrigéfatimthiandoum2003Pas encore d'évaluation
- Cours ProfDocument136 pagesCours ProfMohamed Es-sarghiniPas encore d'évaluation
- TP 2 Constante Des Gaz Parfaits 2023 2024Document2 pagesTP 2 Constante Des Gaz Parfaits 2023 2024votrelueurdespoirPas encore d'évaluation
- Exp01 - MariotteDocument8 pagesExp01 - Mariotteothmane026Pas encore d'évaluation
- Os Chimie Corrige ch2 PDFDocument54 pagesOs Chimie Corrige ch2 PDFFaria HaquePas encore d'évaluation
- Chapitre Ii - L1BCGS - 2023Document13 pagesChapitre Ii - L1BCGS - 2023Daouda KonePas encore d'évaluation
- CHAPITRE I - Notions Générales de La ThermodynamiqueDocument12 pagesCHAPITRE I - Notions Générales de La Thermodynamiquespidef50% (2)
- TP N° 2 (La Masse Moléculaire)Document7 pagesTP N° 2 (La Masse Moléculaire)Imene ImiPas encore d'évaluation
- MACHTHERMQDocument125 pagesMACHTHERMQravonantenaina rakotonindrainyPas encore d'évaluation
- TP Les Gaz ParfaitsDocument5 pagesTP Les Gaz Parfaitsmulungula isalimyaPas encore d'évaluation
- TP N° 2 - La Masse MoléculaireDocument10 pagesTP N° 2 - La Masse MoléculaireNabilDouadiPas encore d'évaluation
- Chapitre II - 2022Document14 pagesChapitre II - 2022aliousadiadiedhiou395Pas encore d'évaluation
- CHAPITRE II - l1cgs2024Document14 pagesCHAPITRE II - l1cgs2024abdoulayetamba08Pas encore d'évaluation
- 2.1 Les Lois Simples Des Gaz - EleveDocument25 pages2.1 Les Lois Simples Des Gaz - Elevebouliga24Pas encore d'évaluation
- TP Loi+de+Gay-LussacDocument6 pagesTP Loi+de+Gay-Lussaclachi nadia100% (1)
- Les Lois Et Les Propriétés de GazDocument21 pagesLes Lois Et Les Propriétés de GazOussama Faratas LainePas encore d'évaluation
- Thermodynamique Industrielle 12Document133 pagesThermodynamique Industrielle 12Bl4ck M4skPas encore d'évaluation
- 1er PrincipeDocument3 pages1er PrincipemohamedPas encore d'évaluation
- COURS ThermodynamiqueDocument107 pagesCOURS ThermodynamiqueOuayad AbdeSsamadPas encore d'évaluation
- TP N° 2 - La Masse Moléculaire - PDFDocument9 pagesTP N° 2 - La Masse Moléculaire - PDFKarim Kisserli100% (1)
- 3 Thermo Partie 3 ESP-TCI (Gaz Parfait)Document14 pages3 Thermo Partie 3 ESP-TCI (Gaz Parfait)Honore herisoaPas encore d'évaluation
- 1-Etat GazeuxDocument53 pages1-Etat Gazeuxjean baptistePas encore d'évaluation
- Gaz ParfaitDocument1 pageGaz ParfaitDadi Yosef Savadi100% (1)
- 2-Etude Des GazDocument33 pages2-Etude Des Gazyoulmafia99Pas encore d'évaluation
- Les Grandeurs Physiques Liés Aux Quantités de MatièresDocument3 pagesLes Grandeurs Physiques Liés Aux Quantités de MatièresraysouhaylPas encore d'évaluation
- Exposé Gaz Parfait Gaz NaturelleDocument25 pagesExposé Gaz Parfait Gaz NaturelleTaourite AmelPas encore d'évaluation
- Thermo 4Document5 pagesThermo 4Renaud Martin-EnglishPas encore d'évaluation
- Guia 3P, Quimica 9Document6 pagesGuia 3P, Quimica 9HenrycorteceroPas encore d'évaluation
- Chapitre IVDocument7 pagesChapitre IVouedraogodri2016Pas encore d'évaluation
- loi de gaz parfaitsDocument6 pagesloi de gaz parfaitsjeanlucmutombo02Pas encore d'évaluation
- Chapitr03 PDFDocument9 pagesChapitr03 PDFZach LeitchPas encore d'évaluation
- TD Premier PrincipeDocument3 pagesTD Premier PrincipeAymane Bitil100% (1)
- Effet JouleDocument6 pagesEffet JouleThierry Gnasiri Godwe HinsouPas encore d'évaluation
- Gaz ParfaitsDocument15 pagesGaz ParfaitsYRO AUBAINPas encore d'évaluation
- Pages Extraites de 00 - Les Grandeurs Physiques Liées Aux Quantités de Matière - Cours 18-19 - V-FinaleDocument4 pagesPages Extraites de 00 - Les Grandeurs Physiques Liées Aux Quantités de Matière - Cours 18-19 - V-FinaleNada khennibaPas encore d'évaluation
- Cours - Notions de ThermochimieDocument18 pagesCours - Notions de Thermochimieachraf22.tataPas encore d'évaluation
- Chimie 2 MateriauxDocument42 pagesChimie 2 Materiauxexaucemakizodila60Pas encore d'évaluation
- MPII Thermodynamique CoursDocument28 pagesMPII Thermodynamique Courszougari190Pas encore d'évaluation
- Enonce TD25Document4 pagesEnonce TD25likasi2098Pas encore d'évaluation
- Les Grandeurs Physiques Liées À La Quantité de Matière - AnwalDocument5 pagesLes Grandeurs Physiques Liées À La Quantité de Matière - AnwalMohamed ElouakilPas encore d'évaluation
- loi de boyle MariotteDocument5 pagesloi de boyle Mariottejeanlucmutombo02Pas encore d'évaluation
- GasesDocument37 pagesGasesdramisiarisoaPas encore d'évaluation
- Chapitre 3 - Le Premier Principe de La ThermodynamiqueDocument12 pagesChapitre 3 - Le Premier Principe de La ThermodynamiquePapa Mbaye BaPas encore d'évaluation
- Changement Climatique: Deux Théories Expliquant le Réchauffement GlobalD'EverandChangement Climatique: Deux Théories Expliquant le Réchauffement GlobalPas encore d'évaluation
- TP POMPE (Réparé)Document15 pagesTP POMPE (Réparé)Nasro DjePas encore d'évaluation
- TP HM 283Document10 pagesTP HM 283Nasro DjePas encore d'évaluation
- TP DebimetresDocument3 pagesTP DebimetresNasro DjePas encore d'évaluation
- TP RDM 2Document4 pagesTP RDM 2Nasro DjePas encore d'évaluation
- TP Mecanique Des FluidesDocument5 pagesTP Mecanique Des FluidesNasro DjePas encore d'évaluation
- TD CissaillementDocument1 pageTD CissaillementNasro DjePas encore d'évaluation
- Faculte Des Hydrocarbures Et de La Chimie Transfert de Chaleur Boumerdes - InhDocument8 pagesFaculte Des Hydrocarbures Et de La Chimie Transfert de Chaleur Boumerdes - InhNasro DjePas encore d'évaluation