1cm3u2tiv 845299
1cm3u2tiv 845299
Transféré par
Absa NdiayeDroits d'auteur :
Formats disponibles
1cm3u2tiv 845299
1cm3u2tiv 845299
Transféré par
Absa NdiayeTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Droits d'auteur :
Formats disponibles
1cm3u2tiv 845299
1cm3u2tiv 845299
Transféré par
Absa NdiayeDroits d'auteur :
Formats disponibles
Cours à domicile: Wahab DIOP - 775136349
Terminale S1 S3 – Année scolaire: 2014 - 2015
Composition n°2 – Epreuve de Sciences Physiques - 4 heures
Exercice n°1:
Au cours d’un devoir de travaux pratiques de cinétique chimique, il est demandé à trois candidats
E1 ; E2 et E3 de réaliser, à température constante 1 et à un instant t=0, le mélange d’une solution (S1)
d’iodure de potassium KI de concentration molaire C1 et de volume V1=200 mL et d’une solution
V
(S2) de peroxodisulfate de potassium K2S2O8 de concentration molaire C2 et de volume V2 = 1.
4
Les candidats doivent répartir le mélange sous forme de prélèvements identiques de volume V afin
de les doser par une solution de thiosulfate de sodium Na2S2O3 de concentration molaire C3=0,2
mol.L-1 pour suivre l’évolution de la réaction de réduction des ions iodures I- par les ions
peroxodisulfate S2O82-.
A l’instant prévu t, ils versent de l’eau distillée glacée dans l’un des prélèvements puis ils dosent la
quantité de matière de diiode formé. Il est demandé au candidat :
- E1 de tracer la courbe d’évolution de l’avancement x au cours du temps. (fig1)
- E2 de tracer la courbe d’évolution de la concentration de diiode formé au cours du temps. (fig 2)
- E3 de tracer la courbe d’évolution de la quantité de matière de l’ion iodure au cours du temps.
(fig3)
x(10-4 mol)
4
n(I-) (10-4 mol)
Fig 1
Fig 3
t(min)
05 10 15
[I2] (mol.L-1)
0,04 8
Fig 2
t(min)
t(min) t1
0 5 10 15 5
1) Ecrire les équations des deux demi-réactions ainsi que l’équation bilan de la réaction des ions
iodures avec les ions peroxodisulfates.
2) Dresser le tableau d’évolution de la réaction précédente en utilisant n0(I-) quantité de matière
initiale des ions iodures et n0(S2O82-) quantité de matière initiale des ions peroxodisulfates.
3) D’après le graphe de la figure :
- 1, prélever la valeur de l’avancement final.
- 2, prélever la valeur de la concentration molaire finale de diiode et déduire le volume V
de chaque prélèvement.
- 3, prélever la quantité de matière finale des ions iodures. Préciser le réactif limitant et
déduire n0(I-) et n0(S2O82-).
4) Trouver C1 et C2.
Site de Wahab Diop - http:physiquechimie.sharepoint.com
Cours à domicile: Wahab DIOP - 775136349
Terminale S1 S3 – Année scolaire: 2014 - 2015
5)
a) Faire un schéma annoté du dispositif du dosage.
b) Ecrire l’équation de la réaction de dosage puis calculer le volume V3 de thiosulfate de sodium
versé à l’équivalence à t=t1 (voir fig 3).
6)
a) Définir la vitesse instantanée d’une réaction chimique.
b) Donner l’expression de la vitesse instantanée établie par chaque candidat pour déterminer
sa valeur à partir du graphe qui l’a tracé.
c) Déterminer la valeur de la vitesse maximale calculée par chaque candidat.
7) Pour étudier l’effet des facteurs cinétiques sur la vitesse de la réaction étudiée, il est demandé au
candidat :
- E1 d’ajouter quelques gouttes d’une solution de sulfate de fer II dans le mélange et de répéter
l’expérience.
- E2 de dissoudre une masse m d’iodure de potassium dans le mélange (sans variation de volume)
et de répéter l’expérience.
- E3 de répéter la même expérience mais à une température 2>1 .
a) Donner la définition d’un catalyseur.
b) Tracer sur le même graphe, l’allure de la courbe obtenue lors de la deuxième expérience
pour chaque candidat.
Exercice n°2:
Une bouteille de vinaigre porte l’indication « vinaigre à 7° » ce qui correspond à 70 g d’acide
éthanoïque par litre. Afin de vérifier cette indication, on prépare une solution S diluée 10 fois à
partir de ce vinaigre. On réalise le dosage pH-métrique de 10 cm3 de cette solution S par une
solution de soude de concentration molaire CB = 0,1mol.L - 1. Soit VBe volume de soude versé. On
obtient les résultats suivants :
VB(cm3) 0 1 2 3 4 5 6 7 8 9 10 11 11,5 12 13 14 15
pH 3,35 3,7 4 4,15 4,3 4,5 4,7 4,8 5 5,25 5,5 6,2 8 9,9 10,8 11 11,15
1) Écrire l’équation bilan de la réaction de dosage.
2) Tracer, sur une feuille de papier millimétré, la courbe traduisant les variations du pH en fonction
du volume VB de soude versé. Échelle : 1cm pour 1 mL et 1cm pour 1 unité de pH
3) Déterminer :
a) les coordonnées du point d’équivalence.
b) en déduire le pKA du couple acide/base étudié.
c) la concentration molaire de la solution acide S.
4) L’indication portée par l’étiquette est-elle exacte ? Justifier la réponse.
5) On considère le mélange obtenu pour VB = 7 mL de soude ajouté.
a) Calculer la concentration molaire des espèces chimique présentes dans le mélange.
b) Retrouver la valeur du pKa déterminé à la question 4°).
c) Nommer ce mélange et préciser ces propriétés.
6) On donne le tableau de quelques indicateurs colorés. Parmi ces indicateurs quel est celui qui est
adapté pour ce dosage ? Justifier votre réponse.
Site de Wahab Diop - http:physiquechimie.sharepoint.com
Cours à domicile: Wahab DIOP - 775136349
Terminale S1 S3 – Année scolaire: 2014 - 2015
Exercice n°3:
Le circuit électrique de la figure 3 comprend en série :
Un générateur de tension alternative sinusoïdale u(t) = Umsin(2Nt) de fréquence N réglable ;
Un condensateur de capacité C = 2 µF ;
Une bobine de résistance r et d’inductance L.
Un résistor de résistance R = 100.
Un ampèremètre et un voltmètre.
1) Pour une fréquence N = N1, on visualise sur un oscilloscope deux tensions suivantes :
- u(t) : aux bornes du générateur sur la (voie I) : sensibilité : 4 V/ division.
- uR(t) : aux bornes du résistor sur la (voie II) : sensibilité : 2V/ division
On obtient les courbes de la figure 4.
a) Etablir l’équation différentielle régissant les variations du courant au cours du temps.
b) Déterminer graphiquement :
La valeur de la fréquence N1 ;
Le déphasage = i - u de l’intensité i(t) du courant par rapport à u(t)
Préciser la nature (inductif ou capacitif ou résistif) du circuit en justifiant la réponse
L’indication de l’ampèremètre.
c) Calculer l’impédance du circuit.
d) Faire la représentation de Fresnel correspondant à l’équation différentielle vérifiée par i et
montrer que r =184 et L =0,38 H. Echelle : 1 cm représente 1V
2) Pour une valeur de N = N0, la tension u(t) devient en phase avec uR(t).
a) Déterminer la valeur de N0 en justifiant la réponse
b) Calculer l’intensité maximale Im.
c) Donner l’indication du voltmètre branché aux bornes B et D du dipôle formé par la bobine et
le condensateur.
d) Exprimer le coefficient de surtension Q en fonction de C, N0, R et r puis calculer sa valeur.
Exercice n°4:
En 1912, le physicien danois Niels Bohr a donné un premier modèle semi-classique, ou « pré-
quantique », de l’électron dans l’atome d’hydrogène, modèle construit sur les trois hypothèses
suivantes :
- le mouvement de l’électron supposé ponctuel, de masse me et de charge ( e), autour du proton,
lui aussi supposé ponctuel, de charge (+e ) s’effectue sous l’effet de la seule force électrostatique
e2
u
de Coulomb f p e que le proton exerce sur l’électron : f p e
4 0 rn2
Site de Wahab Diop - http:physiquechimie.sharepoint.com
Cours à domicile: Wahab DIOP - 775136349
Terminale S1 S3 – Année scolaire: 2014 - 2015
e2 1
- à la force f p e est associée une énergie potentielle égale à : E p , où u est le
4 0 r n
vecteur unitaire dirigé, à tout instant, du proton vers l’électron, rn la distance entre l’électron et
le proton dans l’état stable d’énergie En et 0 la permittivité diélectrique du vide
approximativement égale à 1/(36 109) F.m-1 ;
- les états stables de l’électron sont ceux pour lesquels ce dernier possède un mouvement de
rotation circulaire uniforme, à la vitesse vn , dans un plan contenant le proton qui est le centre de
la trajectoire de l’électron, de rayon rn ;
- les états stables de l’électron sont ceux pour lesquels l’action me vn rn est un multiple entier de
h
, à savoir, dans l’état d’énergie mécanique En : me vn rn = n ħ où n est un entier naturel
2
non nul. On appelle cette relation la « relation de quantification ».
1) Appliquer, en supposant le référentiel du laboratoire dans lequel on procède à l’étude de l’atome
d’hydrogène galiléen, le principe fondamental de la dynamique à l’électron et en déduire une
relation liant v n et r n.
a) À l’aide de la relation de quantification, montrer que les rayons des trajectoires
correspondant à des états stables sont de la forme : r n = r0 · n2 où r0 est à exprimer en
fonction de e, me , 0 et ħ.
b) Calculer la valeur numérique de r0.
2)
a) Rappeler la définition de l’énergie mécanique d’une particule dans un référentiel donné.
b) Exprimer l’énergie mécanique En de l’électron et montrer que celle-ci peut se mettre sous la
E
forme : E n 20 , où E0 est une énergie que l’on exprimera en fonction de e, me , 0 et ħ.
n
c) Calculer la valeur numérique de E0 en joules puis en eV. Comparer sa valeur avec celle
habituellement retenue dans les exercices : 13,6 eV.
3) Représenter les 6 premiers niveaux sur un diagramme à l’échelle 1 cm 1 eV. Ajouter le niveau
E = 0 eV correspondant à l’atome ionisé.
4) Calculer la longueur d’onde d’un photon capable de provoquer la transition de l’atome H de
son niveau fondamental au niveau n = 3. Représenter cette transition sur le diagramme
précédent.
5) Calculer la longueur d’onde correspondant à la transition du niveau 3 au niveau 2. Donner le
résultat en nm. Cette transition correspond-elle à un photon émis ou absorbé ?
6) Etablir l’expression littérale de la longueur d’onde des radiations émises lorsque cet atome
passe d’un état excité tel que n > 2 à l’état n = 2 correspondant à la série nommée série de
Balmer.
7) L’analyse du spectre d’émission de l’atome d’hydrogène révèle la présence de radiations de
longueur d’onde : 656 nm ( ), 486 nm (H ), 434nm ( ), 410 nm ( ).
a) Déterminer à quelles transitions correspondent ces radiations de la série de Balmer.
b) Représenter ces transitions sur le diagramme des niveaux d’énergie de l’hydrogène.
8) Un photon d’énergie 7 eV arrive sur un atome d’hydrogène. Que se passe-t-il si l’atome est
a) dans l’état fondamental b) dans l’état excité n = 2.
9) Un gaz d’hydrogène atomique est porté à la température 2500 K. On admet que les atomes
d’hydrogène se trouvent dans leur état fondamental. Parmi les photons suivants dont on donne
l’énergie quels sont ceux qui sont susceptibles d’être absorbés par les atomes : 8,5eV, 10,2 eV,
13,2 eV, 13,4 eV, 14,5 eV.
Site de Wahab Diop - http:physiquechimie.sharepoint.com
Cours à domicile: Wahab DIOP - 775136349
Terminale S1 S3 – Année scolaire: 2014 - 2015
Exercice n°5:
La détermination de l'âge de la Terre a commencé vers le XVIe siècle, on l'estimait alors autour de
5 000 ans. Au XIXe siècle, des scientifiques admettaient un âge d'environ 100 millions d'années. La
découverte de la radioactivité, par H. Becquerel en 1896, bouleversa toutes les données connues. La
datation à l'uranium - plomb permit de déterminer assez précisément l'âge de la Terre. Nous
proposons de comprendre cette technique de datation.
I. Étude de la famille uranium 238 – plomb 206
Le noyau d'uranium 238, naturellement radioactif, se transforme en un noyau de plomb 206, stable,
par une série de désintégrations successives. Nous allons étudier ce processus. (On ne tiendra pas
compte de l'émission ).
1) Dans la première étape, un noyau d'uranium subit une radioactivité . Le noyau fils est du
thorium (symbole Th).
a) Qu'est-ce qu'un noyau radioactif ?
b) Écrire l'équation de la réaction nucléaire en précisant les règles utilisées.
c) Calculer l’énergie libérée au cours de cette désintégration en joule puis en Mev. On donne :
Symbole du noyau U
238 4
He A
Th
92 2 Z
Masse du noyau (en u) 238,0508 4,0015 234,0436
1u = 1,66.10-27 kg et 1 ev = 1,6.10-19 J.
2) Dans la deuxième étape, le noyau de thorium 234 se transforme en un noyau de protactinium
. L'équation de la réaction nucléaire est : 90Th 91 Pa 1e
234 234 0
a) Donner le type de radioactivité correspondant à cette transformation et préciser son origine.
b) L'équation globale du processus de transformation d'un noyau d'uranium 238 en un noyau
de plomb 206 est : 92 U 82 Pb x 1e y 2 He
238 206 0 4
Déterminer, en justifiant, le nombre de désintégrations et – de ce processus.
II. Géochronologie :
On a constaté d'une part, que les minéraux d'une même couche géologique, donc du même âge,
contiennent de l'uranium 238 et du plomb 206 en proportions remarquablement constantes, et
d'autre part que la quantité de plomb dans un minéral augmente proportionnellement à son âge
relatif.
Si on mesure la quantité de plomb 206 dans un échantillon de roche ancienne, en considérant qu'il
n'y en avait pas initialement, on peut déterminer l'âge du minéral à partir de la courbe de
décroissance radioactive du nombre de noyaux d'uranium 238.
Étudions un échantillon de roche ancienne dont l'âge, noté tTerre, correspond à celui de la Terre.
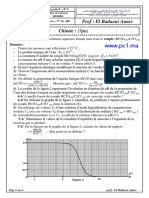
1) On considère la courbe de décroissance radioactive du nombre NU(t) de noyaux d'uranium 238
dans un échantillon de roche ancienne. (figure 1).sachant que - dNU est le nombre de noyaux
qui se désintègrent pendant l’intervalle de temps dt.
a) Prélever à partir du graphe, la quantité initiale NU(0) de noyaux d'uranium.
dNU
b) Montrer que NU(t) vérifie l’équation différentielle NU 0 avec est la constante
dt
radioactive de l’uranium 238.
c) Sachant que la solution de l’équation différentielle précédente s’écrit sous la forme
N (t)=B.e-t/, montrer que B= N (0) et que 1 .
U U
d) Déterminer à partir du graphe la constante de temps de l’uranium 238.
e) Définir la demi-vie T et établir une relation entre T et . Calculer T. Retrouver la valeur de T
graphiquement.
2) La détermination du nombre de noyaux d’uranium 238 est effectuée à l’aide d’un compteur de
Geiger Müller qui mesure l’activité d’un échantillon d’une substance radioactive.
Site de Wahab Diop - http:physiquechimie.sharepoint.com
Cours à domicile: Wahab DIOP - 775136349
Terminale S1 S3 – Année scolaire: 2014 - 2015
a) Définir l’activité radioactive. Calculer, en becquerel, l’activité initiale de l’uranium 238. (une
année =365,25 24 3600 s = 3,15.107 s.)
b) Déterminer graphiquement et par calcul l’activité de l’uranium à t=15.109 années.
3) La quantité de plomb mesurée dans la roche à la date tTerre, notée Npb(tTerre), est égale à
2,5.1012 atomes.
a) Établir la relation entre NU (tTerre), NU(0) et Npb(tTerre). Calculer la quantité NU (tTerre) de
noyaux d'uranium.
b) Déterminer l'âge tTerre de la Terre.
Site de Wahab Diop - http:physiquechimie.sharepoint.com
Vous aimerez peut-être aussi
- 4 Devoirs Controle N°1 Avec Corrections Physique Lycee Pilote SFAX Bac Scientifiques PDFPas encore d'évaluation4 Devoirs Controle N°1 Avec Corrections Physique Lycee Pilote SFAX Bac Scientifiques PDF30 pages
- Chimie Cinétique Chimique 2013 2014 (Afdal Ali)100% (1)Chimie Cinétique Chimique 2013 2014 (Afdal Ali)6 pages
- Devoir de Contrôle N°1 - Sciences Physiques - Bac Sciences Exp (2015-2016) MR ABDAOUI HAMMADI PDFPas encore d'évaluationDevoir de Contrôle N°1 - Sciences Physiques - Bac Sciences Exp (2015-2016) MR ABDAOUI HAMMADI PDF4 pages
- Devoir de Controle N 1 Physique Chimie 4an 2010 2011Pas encore d'évaluationDevoir de Controle N 1 Physique Chimie 4an 2010 20115 pages
- Devoir de Contrôle N°1 - Physique Dipole RC Et Cinétique Chimique - Bac Sciences Exp (2011-2012) MR Profs SadikiPas encore d'évaluationDevoir de Contrôle N°1 - Physique Dipole RC Et Cinétique Chimique - Bac Sciences Exp (2011-2012) MR Profs Sadiki3 pages
- Examen National Physique Chimie Sciences Maths 2012 Rattrapage SujetPas encore d'évaluationExamen National Physique Chimie Sciences Maths 2012 Rattrapage Sujet8 pages
- Devoir de Contrôle N°1 2015 2016 (MR Yousfi Kamel)Pas encore d'évaluationDevoir de Contrôle N°1 2015 2016 (MR Yousfi Kamel)4 pages
- Devoir de Contrôle N°1 - Sciences Physiques - Bac Math (2014-2015) MR FkihPas encore d'évaluationDevoir de Contrôle N°1 - Sciences Physiques - Bac Math (2014-2015) MR Fkih3 pages
- 670ff01fb187f - Série N°4 Cinétique Chimique-1 - (22 - 10 - 2024)Pas encore d'évaluation670ff01fb187f - Série N°4 Cinétique Chimique-1 - (22 - 10 - 2024)5 pages
- Devoir de Synthèse N°1 - Sciences physiques - Bac Sciences exp (2023-2024) Mr Mr. GOUIDER ABDESSATARPas encore d'évaluationDevoir de Synthèse N°1 - Sciences physiques - Bac Sciences exp (2023-2024) Mr Mr. GOUIDER ABDESSATAR3 pages
- Devoir de Contrôle N°1 - Sciences Physiques - Bac Sciences Exp (2012-2013) MR Cherchari, Fki, Abid Et HriziPas encore d'évaluationDevoir de Contrôle N°1 - Sciences Physiques - Bac Sciences Exp (2012-2013) MR Cherchari, Fki, Abid Et Hrizi4 pages
- Devoir de Contrôle N°1 - Sciences physiques - Bac Sciences exp (2013-2014) Mr alibi anouar 2Pas encore d'évaluationDevoir de Contrôle N°1 - Sciences physiques - Bac Sciences exp (2013-2014) Mr alibi anouar 24 pages
- Devoir-de-synthèse-n1.8Bac.sc.pilote.Ali2023Pas encore d'évaluationDevoir-de-synthèse-n1.8Bac.sc.pilote.Ali20235 pages
- Devoir de Contrôle N°1 2016 2017 (MR Handoura Naceur)Pas encore d'évaluationDevoir de Contrôle N°1 2016 2017 (MR Handoura Naceur)4 pages
- Devoir Corrigé de Contrôle N°1 - Sciences Physiques - Bac Sciences Exp (2015-2016) MR TRAYIA NABILPas encore d'évaluationDevoir Corrigé de Contrôle N°1 - Sciences Physiques - Bac Sciences Exp (2015-2016) MR TRAYIA NABIL10 pages
- Devoir de Contrôle N°1 - Physique - Bac Tech (2009-2010) MR Beni HassenPas encore d'évaluationDevoir de Contrôle N°1 - Physique - Bac Tech (2009-2010) MR Beni Hassen4 pages
- 2ème Devoir Du 1er Semestre PCT Tle C 2019-2020 Ceg Du LacPas encore d'évaluation2ème Devoir Du 1er Semestre PCT Tle C 2019-2020 Ceg Du Lac4 pages
- Devoir de Contrôle N°1 2009 2010 (Amara Moncef)Pas encore d'évaluationDevoir de Contrôle N°1 2009 2010 (Amara Moncef)5 pages
- Examen National Physique Chimie Sciences Maths 2018 Normale Sujet PDFPas encore d'évaluationExamen National Physique Chimie Sciences Maths 2018 Normale Sujet PDF8 pages
- الامتحان الوطني في الفيزياء والكيمياء ترجمة فرنسية 2018 مسلك علوم رياضية ترجمة فرنسية الدورة العادية PDFPas encore d'évaluationالامتحان الوطني في الفيزياء والكيمياء ترجمة فرنسية 2018 مسلك علوم رياضية ترجمة فرنسية الدورة العادية PDF20 pages
- Devoir de Contrôle N°1 - Sciences Physiques - Bac Sciences Exp (2014-2015) MR Handoura NaceurPas encore d'évaluationDevoir de Contrôle N°1 - Sciences Physiques - Bac Sciences Exp (2014-2015) MR Handoura Naceur6 pages
- Devoir de Contrôle N°1 - Sciences Physiques - Bac Math (2014-2015) MR Barhoumi EzzedinePas encore d'évaluationDevoir de Contrôle N°1 - Sciences Physiques - Bac Math (2014-2015) MR Barhoumi Ezzedine5 pages
- Applications Des Bases de La Dynamique BisPas encore d'évaluationApplications Des Bases de La Dynamique Bis8 pages
- Capture D'écran . 2024-05-27 À 12.07.53Pas encore d'évaluationCapture D'écran . 2024-05-27 À 12.07.5380 pages
- Le Ministre Des Ressources en Eau Au Siège de LPas encore d'évaluationLe Ministre Des Ressources en Eau Au Siège de L2 pages
- Edfreferentiel2011 111214061750 Phpapp02Pas encore d'évaluationEdfreferentiel2011 111214061750 Phpapp0248 pages
- Programme de Formation de Florian Lucas 5 Jours1582625151Pas encore d'évaluationProgramme de Formation de Florian Lucas 5 Jours15826251513 pages
- Certificat: Tüv Rheinland Cert GMBH Am Grauen Stein 51105 KölnPas encore d'évaluationCertificat: Tüv Rheinland Cert GMBH Am Grauen Stein 51105 Köln1 page
- MEMOIRE TSUANYO (Modélisation Et Caractérisation Dune Turbine de Tesla)Pas encore d'évaluationMEMOIRE TSUANYO (Modélisation Et Caractérisation Dune Turbine de Tesla)57 pages
- Entretien Et Maintenance Des Engins Agricoles - Travaux Pratiques de Moteurs À Essence (Niveau de Base)Pas encore d'évaluationEntretien Et Maintenance Des Engins Agricoles - Travaux Pratiques de Moteurs À Essence (Niveau de Base)47 pages
- 2009 09 Polynesie Exo1 Correction Moto 6ptsPas encore d'évaluation2009 09 Polynesie Exo1 Correction Moto 6pts3 pages
- Energieplus-211130 - Eclairage - LampesAécharges - Tubes FluorescentsPas encore d'évaluationEnergieplus-211130 - Eclairage - LampesAécharges - Tubes Fluorescents6 pages
- Turbomachines Thermiques I - Considérations GénéralesPas encore d'évaluationTurbomachines Thermiques I - Considérations Générales25 pages
- Manuel Du Dépannage Pour Les Produits PelletPas encore d'évaluationManuel Du Dépannage Pour Les Produits Pellet60 pages
- Machines Thermiques: Polycopié Pédagogique100% (1)Machines Thermiques: Polycopié Pédagogique71 pages
- 4 Devoirs Controle N°1 Avec Corrections Physique Lycee Pilote SFAX Bac Scientifiques PDF4 Devoirs Controle N°1 Avec Corrections Physique Lycee Pilote SFAX Bac Scientifiques PDF
- Devoir de Contrôle N°1 - Sciences Physiques - Bac Sciences Exp (2015-2016) MR ABDAOUI HAMMADI PDFDevoir de Contrôle N°1 - Sciences Physiques - Bac Sciences Exp (2015-2016) MR ABDAOUI HAMMADI PDF
- Devoir de Controle N 1 Physique Chimie 4an 2010 2011Devoir de Controle N 1 Physique Chimie 4an 2010 2011
- Devoir de Contrôle N°1 - Physique Dipole RC Et Cinétique Chimique - Bac Sciences Exp (2011-2012) MR Profs SadikiDevoir de Contrôle N°1 - Physique Dipole RC Et Cinétique Chimique - Bac Sciences Exp (2011-2012) MR Profs Sadiki
- Examen National Physique Chimie Sciences Maths 2012 Rattrapage SujetExamen National Physique Chimie Sciences Maths 2012 Rattrapage Sujet
- Devoir de Contrôle N°1 2015 2016 (MR Yousfi Kamel)Devoir de Contrôle N°1 2015 2016 (MR Yousfi Kamel)
- Devoir de Contrôle N°1 - Sciences Physiques - Bac Math (2014-2015) MR FkihDevoir de Contrôle N°1 - Sciences Physiques - Bac Math (2014-2015) MR Fkih
- 670ff01fb187f - Série N°4 Cinétique Chimique-1 - (22 - 10 - 2024)670ff01fb187f - Série N°4 Cinétique Chimique-1 - (22 - 10 - 2024)
- Devoir de Synthèse N°1 - Sciences physiques - Bac Sciences exp (2023-2024) Mr Mr. GOUIDER ABDESSATARDevoir de Synthèse N°1 - Sciences physiques - Bac Sciences exp (2023-2024) Mr Mr. GOUIDER ABDESSATAR
- Devoir de Contrôle N°1 - Sciences Physiques - Bac Sciences Exp (2012-2013) MR Cherchari, Fki, Abid Et HriziDevoir de Contrôle N°1 - Sciences Physiques - Bac Sciences Exp (2012-2013) MR Cherchari, Fki, Abid Et Hrizi
- Devoir de Contrôle N°1 - Sciences physiques - Bac Sciences exp (2013-2014) Mr alibi anouar 2Devoir de Contrôle N°1 - Sciences physiques - Bac Sciences exp (2013-2014) Mr alibi anouar 2
- Devoir de Contrôle N°1 2016 2017 (MR Handoura Naceur)Devoir de Contrôle N°1 2016 2017 (MR Handoura Naceur)
- Devoir Corrigé de Contrôle N°1 - Sciences Physiques - Bac Sciences Exp (2015-2016) MR TRAYIA NABILDevoir Corrigé de Contrôle N°1 - Sciences Physiques - Bac Sciences Exp (2015-2016) MR TRAYIA NABIL
- Devoir de Contrôle N°1 - Physique - Bac Tech (2009-2010) MR Beni HassenDevoir de Contrôle N°1 - Physique - Bac Tech (2009-2010) MR Beni Hassen
- 2ème Devoir Du 1er Semestre PCT Tle C 2019-2020 Ceg Du Lac2ème Devoir Du 1er Semestre PCT Tle C 2019-2020 Ceg Du Lac
- Examen National Physique Chimie Sciences Maths 2018 Normale Sujet PDFExamen National Physique Chimie Sciences Maths 2018 Normale Sujet PDF
- الامتحان الوطني في الفيزياء والكيمياء ترجمة فرنسية 2018 مسلك علوم رياضية ترجمة فرنسية الدورة العادية PDFالامتحان الوطني في الفيزياء والكيمياء ترجمة فرنسية 2018 مسلك علوم رياضية ترجمة فرنسية الدورة العادية PDF
- Devoir de Contrôle N°1 - Sciences Physiques - Bac Sciences Exp (2014-2015) MR Handoura NaceurDevoir de Contrôle N°1 - Sciences Physiques - Bac Sciences Exp (2014-2015) MR Handoura Naceur
- Devoir de Contrôle N°1 - Sciences Physiques - Bac Math (2014-2015) MR Barhoumi EzzedineDevoir de Contrôle N°1 - Sciences Physiques - Bac Math (2014-2015) MR Barhoumi Ezzedine
- Exercices de Physique Nucléaire et de la MatièreD'EverandExercices de Physique Nucléaire et de la Matière
- Exercices d'Ondes, d'Optique et d'ÉlectromagnétismeD'EverandExercices d'Ondes, d'Optique et d'Électromagnétisme
- Programme de Formation de Florian Lucas 5 Jours1582625151Programme de Formation de Florian Lucas 5 Jours1582625151
- Certificat: Tüv Rheinland Cert GMBH Am Grauen Stein 51105 KölnCertificat: Tüv Rheinland Cert GMBH Am Grauen Stein 51105 Köln
- MEMOIRE TSUANYO (Modélisation Et Caractérisation Dune Turbine de Tesla)MEMOIRE TSUANYO (Modélisation Et Caractérisation Dune Turbine de Tesla)
- Entretien Et Maintenance Des Engins Agricoles - Travaux Pratiques de Moteurs À Essence (Niveau de Base)Entretien Et Maintenance Des Engins Agricoles - Travaux Pratiques de Moteurs À Essence (Niveau de Base)
- Energieplus-211130 - Eclairage - LampesAécharges - Tubes FluorescentsEnergieplus-211130 - Eclairage - LampesAécharges - Tubes Fluorescents
- Turbomachines Thermiques I - Considérations GénéralesTurbomachines Thermiques I - Considérations Générales