Raksa
80Hg Raksa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 Raksa elemental dalam bentuk cair | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Garis spektrum raksa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sifat umum | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pengucapan | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Penampilan | cairan mengkilap dan keperakan | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Raksa dalam tabel periodik | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nomor atom (Z) | 80 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Golongan | golongan 12 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Periode | periode 6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Blok | blok-d | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kategori unsur | logam transisi | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Berat atom standar (Ar) |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Konfigurasi elektron | [Xe] 4f14 5d10 6s2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektron per kelopak | 2, 8, 18, 32, 18, 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sifat fisik | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fase pada STS (0 °C dan 101,325 kPa) | cair | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Titik lebur | 234,3210 K (−38,8290 °C, −37,8922 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Titik didih | 629,88 K (356,73 °C, 674,11 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kepadatan mendekati s.k. | 13,534 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Titik tripel | 234,3156 K, 1,65×10−7 kPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Titik kritis | 1750 K, 172,00 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kalor peleburan | 2,29 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kalor penguapan | 59,11 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kapasitas kalor molar | 27,983 J/(mol·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Tekanan uap
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sifat atom | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bilangan oksidasi | −2 , +1, +2 (oksida agak basa) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativitas | Skala Pauling: 2,00 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energi ionisasi | ke-1: 1007,1 kJ/mol ke-2: 1810 kJ/mol ke-3: 3300 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Jari-jari atom | empiris: 151 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Jari-jari kovalen | 132±5 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Jari-jari van der Waals | 155 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Lain-lain | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kelimpahan alami | primordial | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Struktur kristal | rombohedron | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kecepatan suara | cairan: 1451,4 m/s (suhu 20 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ekspansi kalor | 60,4 µm/(m·K) (suhu 25 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Konduktivitas termal | 8,30 W/(m·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Resistivitas listrik | 961 nΩ·m (suhu 25 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Arah magnet | diamagnetik[3] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Suseptibilitas magnetik molar | −33,44×10−6 cm3/mol (293 K)[4] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nomor CAS | 7439-97-6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sejarah | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Penemuan | Orang Mesir Kuno (sebelum 1500 SM) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Simbol | "Hg": dari nama Latin hydrargyrum, ia sendiri berasal dari Yunani hydrárgyros, 'air-perak' | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isotop raksa yang utama | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Raksa atau merkuri (bahasa Inggris: mercury) adalah sebuah unsur kimia dengan lambang Hg dan nomor atom 80. Ia juga dikenal sebagai air raksa dan dulunya bernama hydrargyrum (/haɪˈdrɑːrdʒərəm/ HY-drar-JƏR-əm) dari kata Yunani hydro (air) dan argyros (perak).[5] Merupakan sebuah unsur blok-d yang berat dan keperakan, raksa adalah satu-satunya unsur logam yang diketahui berbentuk cair pada suhu dan tekanan standar; satu-satunya unsur lain yang berwujud cair dalam kondisi ini adalah halogen bromin, meskipun logam seperti sesium, galium, dan rubidium melebur tepat di atas suhu kamar.
Raksa terdapat dalam endapan di seluruh dunia sebagian besar sebagai sinabar (merkurisulfida). Pigmen merah vermilion diperoleh dengan menggiling sinabar alami atau merkurisulfida sintetis.
Raksa digunakan dalam termometer, barometer, manometer, sfigmomanometer, katup pelampung, sakelar raksa, relai raksa, lampu fluoresen, dan perangkat lain, meskipun kekhawatiran mengenai toksisitas unsur ini telah menyebabkan sebagian besar termometer dan sfigmomanometer raksa dihapuskan di lingkungan klinis demi mendukung alternatif seperti termometer kaca berisi alkohol atau galinstan dan instrumen elektronik berbasis termistor atau inframerah. Demikian pula, pengukur tekanan mekanis dan sensor pengukur regangan elektronik telah menggantikan sfigmomanometer raksa. Proses sel raksa (klor-alkali) digunakan untuk menghasilkan klorin dan natrium atau kalium hidroksida, tetapi dihentikan secara bertahap.
Raksa, dan senyawa raksa, tetap digunakan dalam aplikasi penelitian ilmiah dan dalam amalgam untuk restorasi gigi di beberapa tempat, dan di beberapa pabrik makanan. Dalam pembuatan makanan, merkuriklorida digunakan dalam proses ekstraksi pati selama pemurnian beras, jagung, dan gandum untuk menghambat enzim pendegradasi pati.[6][7] Ia juga digunakan dalam lampu fluoresen. Listrik yang melewati uap raksa dalam lampu fluoresen menghasilkan sinar ultraungu gelombang pendek, yang kemudian menyebabkan fosfor di dalam tabung berpendar, membuat cahaya tampak.
Keracunan raksa dapat terjadi akibat paparan raksa yang larut dalam air, (seperti merkuriklorida atau metilraksa), dengan menghirup uap raksa, atau dengan menelan segala bentuk raksa. Dalam bentuk yang serius, penyakit ini juga dikenal sebagai penyakit Minamata. Keracunan raksa diintensifkan dengan paparan bersama timbal.
Karakteristik
[sunting | sunting sumber]Sifat fisik
[sunting | sunting sumber]
Raksa adalah sebuah logam berat berwarna putih keperakan yang berbentuk cair pada suhu kamar. Dibandingkan dengan logam lain, ia adalah konduktor panas yang buruk, tetapi konduktor listrik yang cukup baik.[9]
Ia memiliki titik beku sebesar −38,83 °C dan titik didih sebesar 356,73 °C,[10][11][12] keduanya merupakan nilai terendah untuk logam stabil, meskipun percobaan awal pada kopernisium dan flerovium menunjukkan bahwa mereka memiliki titik didih yang lebih rendah.[13] Efek ini disebabkan oleh kontraksi lantanida dan kontraksi relativistik yang mengurangi jari-jari elektron terluar, sehingga melemahkan ikatan logam pada raksa.[11] Saat membeku, volume raksa berkurang sebanyak 3,59% dan kepadatannya berubah dari 13,69 g/cm3 saat cair menjadi 14,184 g/cm3 when solid. saat padat. Koefisien pemuaian volume raksa adalah 181,59 × 10−6 pada suhu 0 °C, 181,71 × 10−6 pada suhu 20 °C; dan 182,50 × 10−6 pada suhu 100 °C (per °C). Raksa padat dapat ditempa dan ulet serta dapat dipotong dengan pisau.[14]
| Suhu (°C) | Kepadatan (kg/m^3) | Kalor jenis (kJ/kg K) | Kekentalan kinematik (m^2/s) | Konduktivitas (W/m K) | Difusivitas termal (m^2/s) | Bilangan Prandtl | Modulus curah (K^-1) |
| 0 | 13628,22 | 0,1403 | 1,24E-07 | 8,2 | 4,30E-06 | 0,0288 | 0,000181 |
| 20 | 13579,04 | 0,1394 | 1,14E-07 | 8,69 | 4,61E-06 | 0,0249 | 0,000181 |
| 50 | 13505,84 | 0,1386 | 1,04E-07 | 9,4 | 5,02E-06 | 0,0207 | 0,000181 |
| 100 | 13384,58 | 0,1373 | 9,28E-08 | 10,51 | 5,72E-06 | 0,0162 | 0,000181 |
| 150 | 13264,28 | 0,1365 | 8,53E-08 | 11,49 | 6,35E-06 | 0,0134 | 0,000181 |
| 200 | 13144,94 | 0,157 | 8,02E-08 | 12,34 | 6,91E-06 | 0,0116 | 0,000181 |
| 250 | 13025,6 | 0,1357 | 7,65E-08 | 13,07 | 7,41E-06 | 0,0103 | 0,000183 |
| 315,5 | 12847 | 0,134 | 6,73E-08 | 14,02 | 8,15E-06 | 0,0083 | 0,000186 |
Sifat kimia
[sunting | sunting sumber]Raksa tidak bereaksi dengan sebagian besar asam, seperti asam sulfat encer, meskipun asam oksidator seperti asam sulfat pekat dan asam nitrat atau air raja dapat melarutkannya untuk menghasilkan sulfat, nitrat, dan klorida. Seperti perak, raksa akan bereaksi dengan hidrogen sulfida atmosfer. Raksa bereaksi dengan serpihan belerang padat, yang digunakan dalam kit tumpahan raksa untuk menyerap raksa (kit tumpahan juga menggunakan karbon aktif dan bubuk seng).[17]
Amalgam
[sunting | sunting sumber]
Raksa melarutkan banyak logam seperti emas dan perak untuk membentuk amalgam. Pengecualiannya adalah besi, dan termos besi secara tradisional telah digunakan untuk memperdagangkan raksa. Beberapa logam transisi baris pertama lainnya kecuali mangan, tembaga, dan seng juga tahan terhadap pembentukan amalgam. Unsur lain yang tidak mudah membentuk amalgam dengan raksa ialah platina.[18][19] Amalgam natrium adalah agen pereduksi yang umum dalam sintesis organik, dan juga digunakan dalam lampu natrium tekanan tinggi.
Raksa mudah bergabung dengan aluminium untuk membentuk amalgam raksa–aluminium ketika dua logam murni itu bersentuhan. Karena amalgam tersebut dapat menghancurkan lapisan aluminium oksida yang melindungi logam aluminium dari oksidasi mendalam (seperti pada karat besi), bahkan sejumlah kecil raksa dapat menimbulkan korosi serius pada aluminium. Untuk alasan ini, raksa tidak diperbolehkan di dalam pesawat dalam banyak situasi karena risikonya membentuk amalgam dengan bagian aluminium yang terbuka di dalam pesawat.[20]
Penggetasan raksa adalah jenis penggetasan logam cair yang paling umum.
Isotop
[sunting | sunting sumber]Terdapat tujuh isotop raksa yang stabil, dengan 202Hg menjadi yang paling melimpah (29,86%). Radioisotop dengan umur terpanjang adalah 194Hg dengan waktu paruh 444 tahun, dan 203Hg dengan waktu paruh 46,612 hari. Sebagian besar radioisotop yang tersisa memiliki waktu paruh kurang dari satu hari. 199Hg dan 201Hg adalah inti aktif NMR yang paling sering dipelajari, memiliki spin masing-masing ½ dan 3⁄2.[9] Untuk sintesis logam berharga, dua isotop raksa stabil dinilai menarik: isotop renik 196Hg dan 198Hg yang lebih melimpah. Keduanya "kehilangan satu neutron" dari 197Hg, sebuah radioisotop yang meluruh menjadi 197Au, satu-satunya isotop emas stabil yang diketahui. Namun, kelangkaan 196Hg dan kebutuhan energi tinggi untuk reaksi nuklir yang "merobohkan" neutron dari 198Hg (baik melalui fotodisintegrasi atau melalui reaksi (n,2n) yang melibatkan neutron cepat), sejauh ini telah mengesampingkan aplikasi praktis dari "batu filsuf asli" ini.
Etimologi
[sunting | sunting sumber]
"Hg" adalah lambang kimia modern untuk raksa. Ia adalah singkatan dari hydrargyrum, bentuk romanisasi dari nama Yunani Kuno untuk raksa, ὑδράργυρος (hydrargyros). Hydrargyros adalah kata majemuk Yunani yang berarti "air-perak", dari ὑδρ- (hydr-), akar kata ὕδωρ (hydor) "air", dan ἄργυρος (argyros) "perak". Seperti nama Inggris quicksilver ("perak-hidup"), nama ini berasal dari sifat cair dan mengilap raksa.
Nama "merkuri" berasal dari planet Merkurius. Dalam alkimia abad pertengahan, tujuh logam yang dikenal—quicksilver, emas, perak, tembaga, besi, timbal, dan timah—dikaitkan dengan tujuh planet. Quicksilver dikaitkan dengan planet tercepat, yang dinamai dari dewa Romawi Merkurius, yang dikaitkan dengan kecepatan dan mobilitas. Lambang astrologi planet tersebut kemudian menjadi salah satu lambang alkimia untuk logam ini, dan "Merkuri" menjadi nama alternatif untuk logam ini. Merkuri adalah satu-satunya logam di mana nama keplanetan alkimia masih bertahan hingga saat ini, karena nama ini lebih disukai daripada "quicksilver" sebagai nama kimia.[21]
Sejarah
[sunting | sunting sumber]Senyawa raksa yang dikenal sebagai sinabar tercatat sebagai komponen pigmen merah dalam lukisan gua Paleolitikum 30.000 tahun yang lalu di Spanyol dan Prancis.[22]
Raksa ditemukan di kuburan Mesir yang berasal dari tahun 1500 SM.[23]
Di Tiongkok dan Tibet, penggunaan raksa dianggap dapat memperpanjang hidup, menyembuhkan patah tulang, dan menjaga kesehatan secara umum, meskipun sekarang diketahui bahwa paparan uap raksa menyebabkan efek kesehatan yang merugikan.[24] Kaisar pertama dari Tiongkok yang bersatu, Qín Shǐ Huáng Dì—diduga dimakamkan di sebuah makam yang berisi sungai-sungai yang mengalirkan raksa pada model tanah yang dia kuasai, mewakili sungai-sungai di Tiongkok—dilaporkan dibunuh dengan meminum campuran raksa dan bubuk giok yang diformulasikan oleh ahli alkimia Qin yang dimaksudkan sebagai ramuan keabadian.[25][26] Khumarawayh bin Ahmad bin Tulun, penguasa Thuluniyah kedua di Mesir (r. 884–896), yang dikenal karena pemborosannya, dilaporkan membangun sebuah baskom berisi raksa, di mana dia akan berbaring di atas bantal berisi udara dan diayunkan agar dapat tidur.[27]
Pada November 2014, "sejumlah besar" raksa ditemukan di sebuah ruangan 60 kaki di bawah piramida berusia 1800 tahun yang dikenal sebagai "Kuil Ular Berbulu," "piramida Teotihuacan terbesar ketiga," di Meksiko bersama dengan "patung batu giok, sisa-sisa jaguar, sebuah kotak berisi cangkang berukir dan bola karet".[28]
Aristoteles menceritakan bahwa Daidalos membuat sebuah patung kayu Venus bergerak dengan menuangkan air raksa di bagian dalamnya.[29] Dalam mitologi Yunani, Daidalos memberikan penampakan suara pada patung-patungnya menggunakan air raksa. Orang Yunani kuno menggunakan sinabar (raksa sulfida) dalam salep; orang Mesir kuno dan Romawi menggunakannya dalam kosmetik. Di Lamanai, yang pernah menjadi kota besar peradaban Maya, genangan air raksa ditemukan di bawah penanda di sebuah lapangan bola Mesoamerika.[30][31] Pada 500 SM, raksa digunakan untuk membuat amalgam (bahasa Latin Pertengahan: amalgama, "paduan raksa") dengan logam lain.[32]
Ahli alkimia menganggap raksa sebagai Materi Pertama dari mana semua logam terbentuk. Mereka percaya bahwa logam yang berbeda dapat diproduksi dengan memvariasikan kualitas dan kuantitas belerang yang terkandung dalam raksa. Yang paling murni dari mereka adalah emas, dan raksa digunakan dalam upaya transmutasi logam dasar (atau tidak murni) menjadi emas, yang merupakan tujuan dari banyak ahli alkimia.[21]
Tambang di Almadén (Spanyol), Monte Amiata (Italia), dan Idrija (sekarang Slovenia) mendominasi produksi raksa sejak pembukaan tambang di Almadén 2500 tahun yang lalu, hingga endapan baru ditemukan pada akhir abad ke-19.[33]
Pada 8 April 1911, Heike K. Onnes menemukan bahwa pada suhu 4,2 K, kawat raksa padat yang direndam dalam helium cair akan menjadi superkonduktif.[34]
Keterjadian dan produksi
[sunting | sunting sumber]
Raksa adalah unsur yang sangat langka di kerak Bumi, memiliki kelimpahan rata-rata massa kerak hanya 0,08 bagian per juta (ppm).[35] Karena ia tidak menyatu secara geokimia dengan unsur-unsur yang membentuk sebagian besar massa kerak, bijih raksa dapat terkonsentrasi secara luar biasa mengingat kelimpahan unsur ini di batuan biasa. Bijih raksa yang paling kaya mengandung hingga 2,5% raksa berdasarkan massa, dan bahkan deposit yang paling sedikit mengandung raksa setidaknya mengandung 0,1% raksa (12.000 kali rata-rata kelimpahan kerak). Ia ditemukan baik sebagai logam asli (langka) atau pada sinabar, metasinabar, sfalerit, korderoit, livingstonit, dan mineral lainnya, dengan sinabar (HgS) menjadi bijih yang paling umum.[36][37] Bijih raksa sering terjadi di mata air panas atau daerah vulkanik lainnya.[38]
Mulai tahun 1558, dengan penemuan proses patio untuk mengekstraksi perak dari bijih menggunakan raksa, raksa menjadi sumber daya penting dalam perekonomian Spanyol dan koloni Amerikanya. Raksa digunakan untuk mengekstraksi perak dari tambang yang menguntungkan di Spanyol Baru dan Peru. Awalnya, tambang milik Kerajaan Spanyol di Almadén di Spanyol Selatan memasok semua raksa untuk koloninya.[39] Endapan raksa ditemukan di Dunia Baru, dan lebih dari 100.000 ton raksa ditambang dari wilayah Huancavelica, Peru, selama tiga abad setelah penemuan endapan di sana pada tahun 1563. Proses patio dan kemudian proses amalgamasi berlanjut untuk menciptakan permintaan besar akan raksa untuk mengolah bijih perak hingga akhir abad ke-19.[40]
Bekas tambang di Italia, Amerika Serikat, dan Meksiko, yang pernah menghasilkan sebagian besar pasokan dunia, kini telah sepenuhnya habis ditambang atau, dalam kasus Slovenia (Idrija) dan Spanyol (Almadén), ditutup karena jatuhnya harga raksa. Tambang McDermitt di Nevada, tambang raksa terakhir di Amerika Serikat, ditutup pada tahun 1992.[41]
Raksa diekstraksi dengan memanaskan sinabar dalam aliran udara dan mengembunkan uapnya. Persamaan untuk ekstraksi ini adalah
- HgS + O2 → Hg + SO2

Pada tahun 2022, Tiongkok adalah produsen raksa utama, menyediakan 91% dari output dunia (2000 dari 2200 ton), diikuti oleh Tajikistan (120 t), Meksiko (40 t), Peru (30 t), dan Norwegia (20 t).[42]
Karena toksisitas raksa yang tinggi, penambangan sinabar dan penyulingan raksa merupakan penyebab keracunan raksa yang berbahaya dan bersejarah.[43] Di Tiongkok, tenaga kerja penjara digunakan oleh perusahaan pertambangan swasta pada tahun 1950-an untuk mengembangkan tambang sinabar baru. Ribuan tahanan digunakan oleh perusahaan pertambangan Luo Xi untuk membangun terowongan baru.[44] Kesehatan para pekerja di tambang yang berfungsi berisiko tinggi.
Sebuah surat kabar mengklaim bahwa arahan Uni Eropa yang tidak dikenal yang menyerukan agar bola lampu hemat energi diwajibkan pada tahun 2012 mendorong Tiongkok untuk membuka kembali tambang sinabar untuk mendapatkan raksa yang diperlukan untuk pembuatan bola lampu CFL. Bahaya lingkungan telah menjadi perhatian, khususnya di kota-kota selatan Foshan dan Guangzhou, dan di provinsi Guizhou di barat daya.[44]
Lokasi pengolahan tambang raksa yang terbengkalai seringkali mengandung tumpukan limbah kalsin sinabar panggang yang sangat berbahaya. Limpasan air dari lokasi tersebut merupakan sumber kerusakan ekologis yang diakui. Bekas tambang raksa mungkin cocok untuk digunakan kembali secara konstruktif. Misalnya, pada tahun 1976 Santa Clara County, California membeli Tambang Quicksilver Almaden yang bersejarah dan membuat taman daerah di lokasi tersebut, setelah melakukan analisis keselamatan dan lingkungan yang ekstensif terhadap properti tersebut.[45]
Senyawa
[sunting | sunting sumber]Semua senyawa raksa yang diketahui menunjukkan salah satu dari dua keadaan oksidasi positif: I dan II. Percobaan eksperimen telah gagal untuk secara jelas menunjukkan keadaan oksidasi yang lebih tinggi: elektrosintesis tahun 1976 dari spesies Hg(III) yang tidak stabil dan isolasi kriogenik dari HgF4 tahun 2007 yang diklaim, memiliki interpretasi yang diperdebatkan dan tetap sulit (jika bukan tidak mungkin) untuk direproduksi.[46]
Senyawa raksa(I)
[sunting | sunting sumber]Tidak seperti tetangganya yang lebih ringan, kadmium dan seng, raksa biasanya membentuk senyawa stabil sederhana dengan ikatan logam–logam. Sebagian besar senyawa raksa(I) bersifat diamagnetik dan memiliki kation dimerik, Hg2+2. Turunannya yang stabil meliputi klorida dan nitrat. Perlakuan kompleksasi senyawa Hg(I) dengan ligan kuat seperti sulfida, sianida, dll. menginduksi disproporsionasi terhadap Hg2+ dan raksa elemental.[47] Raksa(I) klorida, suatu padatan tak berwarna yang juga dikenal sebagai kalomel, sebenarnya adalah senyawa dengan rumus Hg2Cl2, dengan ikatan Cl–Hg–Hg–Cl. Ia adalah standar dalam elektrokimia. Ia akan bereaksi dengan klorin menghasilkan merkuriklorida, yang menolak oksidasi lebih lanjut. Raksa(I) hidrida, gas tidak berwarna, memiliki rumus HgH, tidak mengandung ikatan Hg–Hg.
Menunjukkan kecenderungannya untuk berikatan dengan dirinya sendiri, raksa dapat membentuk polikation raksa, yang terdiri dari rantai linear pusat raksa, ditutup dengan muatan positif. Salah satu contohnya adalah Hg2+3(AsF−6)2.[48]
Senyawa raksa(II)
[sunting | sunting sumber]Raksa(II) adalah keadaan oksidasi yang paling umum dan juga yang utama di alam. Keempat raksa halida telah diketahui. Mereka membentuk kompleks tetrahedron dengan ligan lain tetapi halida mengadopsi geometri koordinasi linear, seperti yang dilakukan Ag+. Yang paling terkenal adalah raksa(II) klorida, suatu padatan putih yang mudah menyublim. HgCl2 membentuk kompleks koordinasi yang biasanya tetrahedron, misalnya HgCl2−4.
Raksa(II) oksida, oksida utama raksa, muncul ketika logam ini terpapar udara dalam waktu lama pada suhu tinggi. Ia akan kembali ke unsur-unsurnya setelah dipanaskan mendekati suhu 400 °C, seperti yang ditunjukkan oleh Joseph Priestley dalam sintesis awal oksigen murni.[17] Hidroksida raksa dicirikan dengan buruk, sama seperti tetangganya emas dan perak.
Menjadi sebuah logam lunak, raksa membentuk turunan yang sangat stabil dengan kalkogen yang lebih berat. Yang paling unggul adalah raksa(II) sulfida, HgS, yang terjadi di alam sebagai bijih sinabar dan merupakan pigmen cemerlang vermilion. Seperti ZnS, HgS mengkristal dalam dua bentuk, bentuk kubus kemerahan dan bentuk sfalerit hitam.[9] Yang terakhir terkadang terjadi secara alami sebagai metasinabar.[37] Raksa(II) selenida (HgSe) dan raksa(II) telurida (HgTe) juga dikenal, di mana ia serta berbagai turunannya, misalnya raksa kadmium telurida dan raksa seng telurida dapat menjadi semikonduktor yang berguna sebagai bahan pendeteksi inframerah.[49]
Garam raksa(II) membentuk berbagai turunan kompleks dengan amonia. Contohnya adalah basa Millon (Hg2N+), polimer satu dimensi (garam HgNH+2)n), dan "endapan putih yang dapat melebur" atau [Hg(NH3)2]Cl2. Dikenal sebagai reagen Nessler, kalium tetraiodomerkurat(II) (HgI2−4) kadang-kadang masih digunakan untuk menguji amonia karena kecenderungannya untuk membentuk garam iodida yang sangat berwarna dari basa Millon.
Raksa fulminat adalah sebuah detonator yang banyak digunakan dalam bahan peledak.[9]
Senyawa organoraksa
[sunting | sunting sumber]Senyawa raksa organik secara historis dinilai penting tetapi nilai industrinya kecil di dunia barat. Garam raksa(II) adalah contoh langka dari kompleks logam sederhana yang bereaksi langsung dengan cincin aromatik. Senyawa organoraksa selalu dalam keadaan divalen serta biasanya dalam bentuk geometri dua koordinat dan linear. Tidak seperti senyawa organokadmium dan organoseng, senyawa organoraksa tidak bereaksi dengan air. Mereka biasanya memiliki rumus HgR2, yang sering bersifat volatil, atau HgRX, yang sering berwujud padat, di mana R adalah aril atau alkil dan X biasanya halida atau asetat. Metilraksa, istilah umum untuk senyawa dengan rumus CH3HgX, adalah keluarga senyawa berbahaya yang sering ditemukan dalam air yang tercemar.[50] Mereka muncul melalui proses yang dikenal sebagai biometilasi.
Aplikasi
[sunting | sunting sumber]
Raksa digunakan terutama untuk pembuatan bahan kimia industri atau untuk aplikasi listrik dan elektronik. Ia digunakan dalam beberapa termometer cair, terutama yang digunakan untuk mengukur suhu tinggi. Penggunaan raksa yang masih terus meningkat adalah gas raksa dalam lampu fluoresen, sementara sebagian besar aplikasi lainnya perlahan-lahan dihentikan karena peraturan kesehatan dan keselamatan. Dalam beberapa aplikasi, raksa diganti dengan paduan Galinstan yang kurang beracun tetapi jauh lebih mahal.[51]
Kedokteran
[sunting | sunting sumber]
Raksa dan senyawanya telah digunakan dalam pengobatan, meskipun saat ini jauh lebih jarang daripada sebelumnya, karena efek toksik raksa dan senyawanya telah lebih banyak dipahami. Contoh aplikasi terapeutik awal raksa diterbitkan pada tahun 1787 oleh James Lind.[52]
Raksa adalah salah satu bahan dalam amalgam gigi. Tiomersal (disebut Thimerosal di Amerika Serikat) adalah senyawa organik yang digunakan sebagai pengawet dalam vaksin, meskipun penggunaannya telah menurun.[53] Tiomersal dimetabolisme menjadi etil raksa. Meskipun terdapat spekulasi yang luas bahwa pengawet berbasis raksa ini dapat menyebabkan atau memicu autisme pada anak-anak, penelitian ilmiah tidak menunjukkan bukti yang mendukung kaitan tersebut.[54] Namun demikian, tiomersal telah dihapus dari, atau dikurangi menjadi jumlah kecil di semua vaksin A.S. yang direkomendasikan untuk anak-anak berusia 6 tahun ke bawah, dengan pengecualian vaksin influenza yang tidak aktif.[55]
Senyawa raksa lainnya, merbromin (Merkurokrom), adalah antiseptik topikal yang digunakan untuk luka dan goresan ringan yang masih digunakan di beberapa negara.
Raksa dalam bentuk salah satu bijihnya yang umum, sinabar, digunakan dalam berbagai pengobatan tradisional, khususnya pengobatan tradisional Tionghoa. Tinjauan keamanannya telah menemukan bahwa sinabar dapat menyebabkan keracunan raksa yang signifikan ketika dipanaskan, dikonsumsi secara berlebihan, atau dikonsumsi dalam jangka panjang, dan dapat memiliki efek buruk pada dosis terapeutik, meskipun efek dari dosis terapeutik biasanya dapat dibalik. Meskipun bentuk raksa ini tampaknya kurang beracun dibandingkan bentuk lain, penggunaannya dalam pengobatan tradisional Tionghoa belum dibenarkan, karena dasar terapeutik penggunaan sinabar tidaklah jelas.[56]
Saat ini, penggunaan raksa dalam pengobatan telah sangat menurun dalam segala hal, terutama di negara maju. Termometer dan sfigmomanometer yang mengandung raksa ditemukan masing-masing pada awal abad ke-18 dan akhir abad ke-19. Pada awal abad ke-21, penggunaannya semakin menurun dan telah dilarang di beberapa negara, negara bagian, dan institusi medis. Pada tahun 2002, Senat A.S. mengesahkan undang-undang untuk menghentikan penjualan termometer raksa tanpa resep. Pada tahun 2003, Washington dan Maine negara bagian pertama yang melarang perangkat tekanan darah raksa.[57] Senyawa raksa ditemukan di beberapa obat bebas, meliputi antiseptik topikal, obat pencahar stimulan, salep ruam popok, obat tetes mata, dan semprotan hidung. FDA memiliki "data yang tidak memadai untuk menetapkan pengakuan umum atas keamanan dan keefektifan" kandungan raksa dalam produk-produk ini.[58] Raksa masih digunakan dalam beberapa diuretik, meskipun penggantinya sekarang telah ada untuk sebagian besar penggunaan terapeutik.
Produksi klorin dan soda kaustik
[sunting | sunting sumber]Klorin dihasilkan dari natrium klorida (garam biasa, NaCl) menggunakan elektrolisis untuk memisahkan logam natrium dari gas klorin. Biasanya, garam tersebut dilarutkan dalam air untuk menghasilkan air garam. Produk sampingan dari proses kloralkali semacam itu adalah hidrogen (H2) dan natrium hidroksida (NaOH), yang biasa disebut soda kaustik atau lindi. Sejauh ini, penggunaan raksa terbesar[59][60] pada akhir abad ke-20 adalah dalam proses sel raksa (juga disebut proses Castner–Kellner) di mana logam natrium dibentuk sebagai amalgam pada katoda yang terbuat dari raksa; natrium ini kemudian direaksikan dengan air untuk menghasilkan natrium hidroksida.[61] Banyak pelepasan raksa industri abad ke-20 berasal dari proses ini, meskipun tumbuhan modern diklaim aman dalam hal ini.[60] Setelah sekitar tahun 1985, semua fasilitas produksi kloralkali baru yang dibangun di Amerika Serikat menggunakan teknologi sel membran atau sel diafragma untuk memproduksi klorin.
Penggunaan laboratorium
[sunting | sunting sumber]Beberapa termometer medis, terutama untuk suhu tinggi, diisi dengan raksa; mereka secara bertahap menghilang. Di Amerika Serikat, penjualan termometer demam berisi raksa tanpa resep telah dilarang sejak tahun 2003.[62]
Beberapa teleskop transit menggunakan baskom air raksa untuk membentuk cermin datar dan benar-benar horizontal, berguna dalam menentukan referensi mutlak vertikal atau tegak lurus. Cermin parabola horizontal cekung dapat dibentuk dengan memutar raksa cair pada piringan, bentuk parabola dari cairan yang terbentuk akan memantulkan dan memfokuskan cahaya datang. Teleskop cermin cair semacam itu lebih murah daripada teleskop cermin besar konvensional hingga faktor 100, tetapi cermin ini tidak dapat dimiringkan dan selalu mengarah lurus ke atas.[63][64][65]
Raksa cair adalah bagian dari elektroda referensi sekunder yang populer (disebut elektroda kalomel) dalam elektrokimia sebagai alternatif dari elektroda hidrogen standar. Elektroda kalomel digunakan untuk menghitung potensial elektroda setengah sel.[66] Terakhir, titik tripel raksa, −38,8344 °C, adalah titik tetap yang digunakan sebagai standar suhu untuk Skala Suhu Internasional (ITS-90).[9]
Dalam polarografi, baik elektroda raksa tetes[67] maupun elektroda tetes raksa gantung[68] menggunakan raksa elemental. Penggunaan ini memungkinkan tersedianya elektroda baru yang tidak terkontaminasi untuk setiap pengukuran atau setiap percobaan baru.
Senyawa yang mengandung raksa juga digunakan dalam bidang biologi struktur. Senyawa raksa seperti raksa(II) klorida atau kalium tetraiodomerkurat(II) dapat ditambahkan pada kristal protein dalam upaya untuk membuat turunan atom berat yang dapat digunakan untuk menyelesaikan masalah fase dalam kristalografi sinar-X melalui metode penggantian isomorf atau hamburan anomali.
Penggunaan pasar
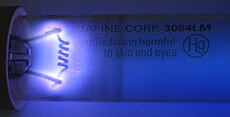
[sunting | sunting sumber]Raksa berwujud gas digunakan dalam lampu uap raksa serta beberapa tanda iklan jenis "tanda neon" dan lampu fluoresen. Lampu bertekanan rendah tersebut memancarkan garis yang sangat sempit secara spektral, yang secara tradisional digunakan dalam spektroskopi optik untuk kalibrasi posisi spektral. Lampu kalibrasi komersial dijual untuk tujuan ini; memantulkan lampu langit-langit fluoresen ke dalam spektrometer adalah praktik kalibrasi yang umum.[69] Raksa gas juga ditemukan di beberapa tabung elektron, meliputi ignitron, tiratron, dan penyearah busur raksa.[70] Ia juga digunakan dalam lampu perawatan medis spesialis untuk penyamakan kulit dan disinfeksi.[71] Raksa gas ditambahkan pada lampu katoda dingin berisi argon untuk meningkatkan ionisasi dan konduktivitas listrik. Lampu berisi argon tanpa raksa akan menyala secara salah dan memiliki bintik-bintik kusam. Lampu yang mengandung raksa hanya dapat dibombardir/dipompa oven satu kali. Saat ditambahkan pada tabung berisi neon, cahaya yang dihasilkan akan memiliki bintik merah/biru yang tidak konsisten hingga proses pembakaran awal selesai; pada akhirnya, ia akan menyala dengan warna biru pudar yang konsisten dan kusam.[72]
-
Cahaya lembayung tua dari lucutan uap raksa dalam lampu germisida, di mana spektrumnya kaya akan radiasi ultraungu yang tak terlihat.
-
Penyamak kulit mengandung lampu uap raksa bertekanan rendah dan dua lampu inframerah, yang berfungsi sebagai sumber cahaya dan pengimbang listrik
-
Berbagai macam jenis lampu fluoresen.
-
Miniatur Deep Space Atomic Clock adalah jam ion raksa berbasis perangkap ion linear, yang dirancang untuk navigasi radio yang tepat dan langsung di luar angkasa.
Deep Space Atomic Clock (DSAC) yang sedang dikembangkan oleh Jet Propulsion Laboratory menggunakan raksa dalam jam linear berbasis perangkap ion. Penggunaan baru raksa ini memungkinkan jam atom yang sangat kompak dengan kebutuhan energi rendah, dan karena itu ideal untuk digunakan pada wahana antariksa dan misi Mars.[73]
Kosmetik
[sunting | sunting sumber]Raksa, sebagai tiomersal, banyak digunakan dalam pembuatan maskara. Pada tahun 2008, Minnesota menjadi negara bagian pertama di Amerika Serikat yang melarang penambahan raksa secara sengaja ke dalam kosmetik, memberikan standar yang lebih ketat daripada pemerintah federal.[74]
Sebuah penelitian mengenai konsentrasi raksa urine rata-rata geometris mengidentifikasi sumber paparan (produk perawatan kulit) raksa anorganik yang sebelumnya tidak dikenal di antara penduduk Kota New York. Pemantauan biologis berbasis populasi juga menunjukkan bahwa tingkat konsentrasi raksa lebih tinggi pada konsumen makanan laut dan ikan.[75]
Pemutih kulit
[sunting | sunting sumber]Raksa efektif sebagai sebuah bahan aktif senyawa pemutih kulit yang digunakan untuk depigmentasi kulit.[76] Konvensi Minamata mengenai Raksa membatasi konsentrasi raksa dalam pemutih kulit menjadi 1 bagian per juta. Namun, mulai tahun 2022, banyak produk pemutih yang dijual secara komersial terus melampaui batas tersebut, dan dianggap beracun.[77]
Senjata api
[sunting | sunting sumber]Raksa(II) fulminat adalah sebuah bahan peledak primer yang digunakan terutama sebagai primer dari selongsong dalam senjata api.
Penggunaan historis
[sunting | sunting sumber]

Banyak aplikasi bersejarah memanfaatkan sifat fisik raksa yang khas, terutama sebagai cairan padat dan logam cair:
- Raksa cair dalam jumlah mulai dari 90 hingga 600 gram (3,2 hingga 21,2 oz) telah ditemukan dari makam elit Maya (100–700 M)[28] atau tempat penyimpanan ritual di enam lokasi. Raksa ini mungkin telah digunakan dalam mangkuk sebagai cermin untuk tujuan meramal. Lima di antaranya berasal dari Periode Klasik peradaban Maya (sekitar 250–900) tetapi satu contoh mendahuluinya.[78]
- Di Spanyol Islam, ia digunakan untuk mengisi kolam dekoratif. Kemudian, seniman Amerika Alexander Calder membangun sebuah air mancur raksa untuk Paviliun Spanyol pada Pameran Dunia 1937 di Paris. Air mancur tersebut sekarang dipajang di Fundació Joan Miró di Barcelona.[79]
- Raksa digunakan di dalam umpan kail. Bentuknya yang berat dan cair membuatnya berguna karena umpan tersebut membuat gerakan tidak teratur yang menarik saat raksa bergerak di dalamnya. Penggunaan semacam itu telah dihentikan karena masalah lingkungan, tetapi pembuatan ilegal dari kail penangkapan ikan ini modern banyak terjadi.
- Lensa Fresnel dari mercusuar tua biasanya mengapung dan berputar di bak air raksa yang berfungsi seperti bantalan.[80]
- Sfigmomanometer raksa (pengukur tekanan darah), barometer, pompa difusi, koulometer, dan banyak instrumen laboratorium lainnya memanfaatkan sifat raksa sebagai cairan buram yang sangat padat dengan ekspansi termal yang hampir linear.[81]
- Sebagai cairan penghantar listrik, ia digunakan dalam sakelar raksa (termasuk sakelar lampu raksa rumah yang dipasang sebelum tahun 1970), sakelar kemiringan yang digunakan dalam detektor api lama, dan sakelar kemiringan di beberapa termostat rumah.[82]
- Karena sifat akustiknya, raksa digunakan sebagai media propagasi dalam perangkat memori garis tunda yang digunakan pada komputer digital awal pada pertengahan abad ke-20.
- Turbin uap raksa eksperimental dipasang untuk meningkatkan efisiensi pembangkit listrik berbahan bakar fosil.[83] Pembangkit listrik South Meadow di Hartford, CT menggunakan raksa sebagai fluida kerjanya, dalam konfigurasi biner dengan sirkuit air sekunder, selama beberapa tahun mulai akhir 1920-an dalam upaya meningkatkan efisiensi pembangkit. Beberapa pabrik lain dibangun, termasuk Stasiun Schiller di Portsmouth, NH, yang mulai beroperasi pada tahun 1950. Ide tersebut tidak tersebar luas dalam industri karena berat dan toksisitas raksa, serta munculnya pembangkit uap superkritis bertahun-tahun kemudian.[84][85]
- Demikian pula, raksa cair digunakan sebagai pendingin untuk beberapa reaktor nuklir; namun, natrium diusulkan untuk reaktor yang didinginkan dengan logam cair, karena kepadatan raksa yang tinggi membutuhkan lebih banyak energi untuk bersirkulasi sebagai pendingin.[86]
- Raksa adalah propelan untuk mesin ion awal dalam sistem propulsi ruang angkasa listrik. Keuntungannya adalah berat molekul raksa yang tinggi, energi ionisasi yang rendah, energi ionisasi ganda yang rendah, kerapatan cairan yang tinggi, dan daya simpan cairan pada suhu kamar. Kerugiannya adalah kekhawatiran mengenai dampak lingkungan yang terkait dengan pengujian di darat dan kekhawatiran mengenai pendinginan dan kondensasi beberapa propelan pada wahana antariksa dalam operasi jangka panjang. Penerbangan luar angkasa pertama yang menggunakan propulsi listrik adalah pendorong ion berbahan bakar raksa yang dikembangkan di Pusat Penelitian Glenn NASA dan diterbangkan pada Space Electric Rocket Test "SERT-1" yang diluncurkan oleh NASA di Fasilitas Penerbangan Wallops pada tahun 1964. Penerbangan SERT-1 diikuti oleh penerbangan SERT-2 pada tahun 1970. Raksa dan sesium adalah propelan pilihan untuk mesin ion sampai Laboratorium Penelitian Hughes melakukan penelitian yang menemukan bahwa gas xenon dapat menjadi pengganti yang cocok. Xenon sekarang menjadi propelan pilihan untuk mesin ion karena memiliki berat molekul tinggi, sedikit atau tidak memiliki reaktivitas karena sifat gas mulianya, dan memiliki kerapatan cairan yang tinggi di bawah penyimpanan kriogenik ringan.[87][88]
Aplikasi lain memanfaatkan sifat kimia raksa:
- Baterai raksa adalah baterai elektrokimia yang tidak dapat diisi ulang, sebuah sel primer, yang umum pada pertengahan abad ke-20. Ia digunakan dalam berbagai aplikasi dan tersedia dalam berbagai ukuran, terutama ukuran tombol. Output voltasenya yang konstan dan umur simpan yang lama membuatnya cocok digunakan untuk pengukur cahaya kamera dan alat bantu dengar. Sel raksa secara efektif dilarang di sebagian besar negara pada 1990-an karena kekhawatiran mengenai tempat pembuangan sampah yang dicemari raksa.[89]
- Raksa digunakan untuk mengawetkan kayu, mengembangkan daguerreotype, pelapisan reflektif cermin, cat antipenumpukan (dihentikan pada tahun 1990), herbisida (dihentikan pada tahun 1995), cat lateks interior, permainan labirin genggam, pembersih, dan perangkat perataan jalan pada mobil. Senyawa raksa telah digunakan dalam antiseptik, pencahar, antidepresan, dan antisifilis.
- Ia diduga digunakan oleh mata-mata sekutu untuk menyabotase pesawat Luftwaffe: pasta raksa dioleskan ke aluminium kosong, menyebabkan logam tersebut cepat berkarat; ini akan menyebabkan kegagalan struktural.[90]
- Proses kloralkali: Penggunaan industri raksa terbesar selama abad ke-20 adalah dalam elektrolisis untuk memisahkan klorin dan natrium dari air garam; raksa menjadi anoda dalam proses Castner–Kellner. Klorin digunakan untuk memutihkan kertas (maka lokasi dari banyak pabrik proses ini berada di dekat pabrik kertas) sedangkan natrium digunakan untuk membuat natrium hidroksida untuk sabun dan produk pembersih lainnya.[91] Meskipun penggunaan ini sebagian besar telah dihentikan dan diganti dengan teknologi lain yang memanfaatkan sel membran,[91] Laporan Dewan Klorin Dunia menunjukkan masih ada sebelas pabrik yang beroperasi di Amerika Utara dan Selatan pada tahun 2020.[92]
- Sebagai elektroda dalam beberapa jenis elektrolisis, baterai (sel raksa), produksi natrium hidroksida dan klorin, permainan genggam, katalis, insektisida.
- Raksa pernah digunakan sebagai pembersih lubang laras senapan.[93][94]
- Dari pertengahan abad ke-18 hingga pertengahan abad ke-19, sebuah proses yang disebut "carroting" digunakan dalam pembuatan topi felt. Kulit binatang dibilas dalam larutan jingga (istilah "carroting" muncul dari warna ini) dari senyawa raksa merkurinitrat, Hg(NO3)2·2H2O.[95] Proses ini memisahkan bulu dari kulitnya dan menyatukannya. Larutan ini dan uap yang dihasilkannya sangatlah beracun. Dinas Kesehatan Masyarakat Amerika Serikat melarang penggunaan raksa dalam industri felt pada bulan Desember 1941. Gejala psikologis yang terkait dengan keracunan raksa mengilhami ungkapan "mad as a hatter". Tokoh "Mad Hatter" karya Lewis Carroll dalam bukunya Alice's Adventures in Wonderland adalah permainan kata berdasarkan ungkapan yang lebih tua, tetapi tokoh itu sendiri tidak menunjukkan gejala keracunan raksa.[96]
- Penambangan emas dan perak. Secara historis, raksa digunakan secara luas dalam penambangan emas hidrolik untuk membantu emas tenggelam melalui campuran air-kerikil yang mengalir. Partikel tipis emas dapat membentuk amalgam raksa–emas sehingga daat meningkatkan tingkat pemulihan emas.[9] Penggunaan raksa dalam skala besar berhenti pada 1960-an. Namun, raksa masih digunakan dalam pencarian emas skala kecil, seringkali secara sembunyi-sembunyi. Diperkirakan bahwa 45.000 ton metrik raksa yang digunakan di California untuk pertambangan plaser belum dipulihkan kembali.[97] Raksa juga digunakan dalam penambangan perak.[98]
Penggunaan pengobatan historis
[sunting | sunting sumber]Raksa(I) klorida (juga dikenal sebagai kalomel atau merkuroklorida) telah digunakan dalam pengobatan tradisional sebagai diuretik, disinfektan topikal, dan pencahar. Raksa(II) klorida (juga dikenal sebagai merkuriklorida atau sublimat korosif) pernah digunakan untuk mengobati sifilis (bersama dengan senyawa raksa lainnya), meskipun ia sangat beracun sehingga terkadang gejala toksisitasnya dikacaukan dengan gejala sifilis yang diyakini dapat diobati.[99] Ia juga digunakan sebagai desinfektan. Massa biru, pil atau sirup yang mengandung raksa sebagai bahan utamanya, diresepkan sepanjang abad ke-19 untuk berbagai kondisi meliputi sembelit, depresi, melahirkan anak, dan sakit gigi.[100] Pada awal abad ke-20, raksa diberikan kepada anak-anak setiap tahun sebagai pencahar dan obat cacing, dan digunakan dalam bubuk tumbuh gigi untuk bayi. Organohalida yang mengandung raksa merbromin (terkadang dijual sebagai Mercurochrome) masih banyak digunakan tetapi telah dilarang di beberapa negara seperti Amerika Serikat.[101]
Toksisitas dan keamanan
[sunting | sunting sumber]| Bahaya | |
|---|---|
| Piktogram GHS |   
|
| Keterangan bahaya GHS | {{{value}}} |
| H330, H372, H410 | |
| P201, P260, P273, P280, P304, P340, P310, P308, P313, P391, P403, P233[102] | |
Raksa dan sebagian besar senyawanya sangat beracun dan harus ditangani dengan hati-hati; dalam kasus tumpahan yang melibatkan raksa (seperti dari termometer atau bola lampu fluoresen tertentu), prosedur pembersihan khusus harus dijalankan untuk menghindari paparan dan menampung tumpahan.[103] Protokol menyerukan untuk secara fisik menggabungkan tetesan yang lebih kecil pada permukaan yang keras, menggabungkannya menjadi satu kolam yang lebih besar untuk memudahkan pembuangan dengan sebuah pipet, atau dengan mendorong tumpahan secara lembut ke dalam wadah sekali pakai. Penyedot debu dan sapu menyebabkan penyebaran raksa yang lebih besar dan tidak boleh digunakan. Setelah itu, belerang, seng, atau bubuk halus lain yang dapat membentuk amalgam (paduan) dengan raksa pada suhu biasa ditaburkan di atas area tersebut sebelum dikumpulkan dan dibuang dengan benar. Membersihkan permukaan dan pakaian yang berpori tidak efektif untuk menghilangkan semua jejak raksa dan oleh karena itu disarankan untuk membuang barang-barang semacam ini jika terkena tumpahan raksa.
Raksa dapat diserap melalui kulit dan selaput lendir serta uap raksa dapat terhirup, sehingga wadah yang menampung raksa harus tertutup rapat untuk menghindari tumpahan dan penguapan. Pemanasan raksa, atau senyawa raksa yang dapat terurai saat dipanaskan, harus dilakukan dengan ventilasi yang memadai untuk meminimalkan paparan uap raksa.
Bentuk raksa yang paling beracun adalah senyawa organiknya, seperti dimetilraksa dan metilraksa. Raksa anorganik, dengan sendirinya, bagaimanapun, sangat beracun dengan paparan bersama timbal selama perkembangan anak.[104][105][106] Paparan raksa anorganik dikaitkan dengan perkembangan diabetes tipe-2 pada populasi manusia.[107][108] Raksa dapat menyebabkan keracunan kronis dan akut.
Paparan makanan terhadap raksa
[sunting | sunting sumber]Pada tahun 2021, Kongres Amerika Serikat mengeluarkan laporan mengenai masalah logam berat dalam makanan bayi, termasuk raksa dan timbal.[109][110][111][112] Para sarjana telah mempelajari efek paparan raksa anorganik makanan dari konsumsi makanan olahan.[113]
Pelepasan di lingkungan
[sunting | sunting sumber]
Laju pengendapan raksa praindustri dari atmosfer mungkin sekitar 4 ng /(1 L endapan es). Meskipun itu dapat dianggap sebagai tingkat keterpaparan alami, sumber regional atau global memiliki pengaruh yang signifikan. Letusan gunung berapi dapat meningkatkan sumber atmosfer sebanyak 4–6 kali.[114]
Sumber alami, seperti gunung berapi, bertanggung jawab atas sekitar setengah dari emisi raksa atmosfer. Setengah yang dihasilkan manusia dapat dibagi menjadi persentase perkiraan berikut:[115][116][117]
- 65% dari pembakaran stasioner, di mana pembangkit listrik berbahan bakar batu bara merupakan sumber agregat terbesar (40% dari emisi raksa A.S. pada tahun 1999). Ini termasuk pembangkit listrik berbahan bakar gas di mana raksa belum dihilangkan. Emisi dari pembakaran batu bara antara satu dan dua kali lipat lebih tinggi daripada emisi dari pembakaran minyak, tergantung negaranya.[115]
- 11% dari produksi emas. Tiga titik sumber emisi raksa terbesar di A.S. adalah tiga tambang emas terbesar. Pelepasan raksa hidrogeokimia dari tailing tambang emas telah dianggap sebagai sumber raksa atmosfer yang signifikan di Kanada bagian timur.[118]
- 6,8% dari produksi logam nonfero, biasanya pelebur.
- 6,4% dari produksi semen.
- 3,0% dari pembuangan limbah, termasuk limbah perkotaan dan berbahaya, krematorium, dan pembakaran lumpur limbah.
- 3,0% dari produksi soda kaustik.
- 1,4% dari produksi besi kasar dan baja.
- 1,1% dari produksi raksa, terutama untuk baterai.
- 2,0% dari sumber lain.
Persentase di atas adalah perkiraan emisi raksa global yang disebabkan manusia pada tahun 2000, tidak termasuk pembakaran biomassa, sumber penting di beberapa wilayah.[115]
Kontaminasi raksa atmosfer baru-baru ini di udara perkotaan luar ruangan diukur pada 0,01–0,02 μg/m3. Sebuah penelitian tahun 2001 mengukur kadar raksa di 12 lokasi dalam ruangan yang dipilih untuk mewakili penampang lintang tipe bangunan, lokasi, dan usia di wilayah New York. Penelitian ini menemukan bahwa konsentrasi raksa meningkat secara signifikan dibandingkan konsentrasi di luar ruangan, pada kisaran 0,0065 – 0,523 μg/m3. Rata-ratanya adalah 0,069 μg/m3.[119]
Danau buatan, atau waduk, dapat terkontaminasi raksa karena penyerapan air raksa dari pohon dan tanah yang terendam. Misalnya, Danau Williston di British Columbia bagian utara, yang tercipta akibat bendungan Sungai Peace pada tahun 1968, masih cukup terkontaminasi raksa sehingga tidak disarankan untuk mengonsumsi ikan dari danau tersebut.[120][121] Tanah ibun abadi telah mengakumulasi raksa melalui pengendapan atmosfer,[122] dan pencairan ibun abadi di daerah kriosferik juga merupakan mekanisme pelepasan raksa ke danau, sungai, dan lahan basah.[123][124]
Raksa juga masuk ke lingkungan melalui pembuangan produk tertentu yang tidak tepat (misalnya, penimbunan tanah, pembakaran). Produk yang mengandung raksa meliputi: suku cadang mobil, baterai, bola lampu fluoresen, produk medis, termometer, dan termostat.[125] Karena masalah kesehatan (lihat di bawah), upaya pengurangan penggunaan racun adalah untuk mengurangi atau menghilangkan raksa dalam produk tersebut. Misalnya, jumlah raksa yang dijual di termostat di Amerika Serikat menurun dari 14,5 ton pada tahun 2004 menjadi 3,9 ton pada tahun 2007.[126]
Sebagian besar termometer sekarang menggunakan alkohol berpigmen, bukan raksa. Termometer air raksa kadang-kadang masih digunakan dalam bidang medis karena lebih akurat daripada termometer alkohol, meskipun keduanya umumnya digantikan oleh termometer elektronik dan lebih jarang oleh termometer galinstan. Termometer raksa masih banyak digunakan untuk aplikasi ilmiah tertentu karena akurasi dan jangkauan kerjanya yang lebih besar.
Sumber raksa yang kurang terkenal adalah pembakaran kertas dupa,[127] yang merupakan praktik yang sangat umum di tempat-tempat Asia seperti Tiongkok,[128] Vietnam, Hong Kong, Thailand, Taiwan, dan Malaysia.[129]
Secara historis, salah satu pelepasan terbesar berasal dari pabrik Colex, pabrik pemisahan isotop litium di Oak Ridge, Tennessee. Pabrik tersebut beroperasi pada 1950-an dan 1960-an. Catatannya tidak lengkap dan tidak jelas, tetapi komisi pemerintah memperkirakan sekitar dua juta pon raksa belum ditemukan.[130]
Bencana industri yang serius adalah pembuangan limbah senyawa raksa ke Teluk Minamata, Jepang, antara tahun 1932 dan 1968. Diperkirakan lebih dari 3.000 orang menderita berbagai kelainan bentuk, gejala keracunan raksa yang parah, atau kematian yang kemudian dikenal sebagai penyakit Minamata.[131][132]
Tumbuhan tembakau dengan mudah menyerap dan mengakumulasi logam berat seperti raksa dari tanah di sekitarnya ke dalam daunnya. Ini kemudian dihirup selama pengisapan tembakau.[133] Walaupun raksa adalah konstituen asap tembakau,[134] sebagian besar penelitian gagal menemukan korelasi yang signifikan antara pengisapan dan penyerapan Hg oleh manusia dibandingkan dengan sumber lain seperti paparan pekerjaan, konsumsi ikan, dan tambalan gigi amalgam.[135]
Kontaminasi sedimen
[sunting | sunting sumber]Sedimen di dalam muara industri-perkotaan yang besar bertindak sebagai tempat pembuangan yang penting untuk sumber titik dan polusi raksa yang tersebar di dalam daerah tangkapan air.[136] Sebuah penelitian tahun 2015 mengenai sedimen tepi pantai dari muara Thames mengukur total raksa pada 0,01 hingga 12,07 mg/kg dengan rata-rata 2,10 mg/kg dan median 0,85 mg/kg (n=351).[136] Konsentrasi raksa tertinggi terjadi di dalam dan sekitar kota London terkait dengan lumpur butiran halus dan kandungan karbon organik total yang tinggi.[136] Afinitas raksa yang kuat untuk sedimen kaya karbon juga telah teramati pada sedimen rawa asin di Sungai Mersey dengan rata-rata 2 mg/kg hingga 5 mg/kg.[137] Konsentrasi ini jauh lebih tinggi daripada yang ditunjukkan pada sedimen sungai sungai rawa asin di New Jersey dan hutan bakau di Tiongkok Selatan yang menunjukkan konsentrasi raksa rendah sekitar 0,2 mg/kg.[138][139]
Paparan pekerjaan
[sunting | sunting sumber]
Karena efek kesehatan dari paparan raksa, penggunaan industri dan komersial raksa diatur di banyak negara. Organisasi Kesehatan Dunia, OSHA, dan NIOSH semuanya memperlakukan raksa sebagai bahaya pekerjaan, dan telah menetapkan batas paparan pekerjaan spesifik. Pelepasan dan pembuangan raksa ke lingkungan diatur di A.S. terutama oleh Badan Perlindungan Lingkungan Amerika Serikat.
Ikan
[sunting | sunting sumber]Ikan dan kerang memiliki kecenderungan alami untuk mengonsentrasikan raksa dalam tubuh mereka, seringkali dalam bentuk metilraksa, sebuah senyawa organik raksa yang sangat beracun. Spesies ikan yang berada pada rantai makanan tingkat tinggi, seperti hiu, todak, tenggiri amerika, tuna sirip biru, tuna albakora, dan jabad mengandung konsentrasi raksa yang lebih tinggi daripada yang lain. Karena raksa dan metilraksa larut dalam lemak, mereka menumpuk terutama di viscera, meskipun juga ditemukan di seluruh jaringan otot.[140] Kehadiran raksa dalam otot ikan dapat dipelajari dengan menggunakan biopsi otot yang tidak mematikan.[141] Raksa yang ada pada ikan mangsa akan terakumulasi dalam predator yang memakannya. Karena ikan kurang efisien dalam membersihkan daripada mengakumulasi metilraksa, konsentrasi metilraksa dalam jaringan ikan akan meningkat dari waktu ke waktu. Jadi, spesies yang tinggi dalam rantai makanan mengumpulkan beban raksa dalam tubuh mereka yang bisa sepuluh kali lebih tinggi daripada spesies yang mereka konsumsi. Proses ini disebut biomagnifikasi. Keracunan raksa terjadi seperti ini di Minamata, Jepang, yang sekarang disebut penyakit Minamata.
Kosmetik
[sunting | sunting sumber]Beberapa krim wajah mengandung kadar raksa yang berbahaya. Sebagian besar mengandung raksa anorganik yang relatif tidak beracun, tetapi produk yang mengandung raksa organik yang sangat beracun telah ditemukan.[142][143]
Efek dan gejala keracunan raksa
[sunting | sunting sumber]Efek toksik meliputi kerusakan pada otak, ginjal dan paru-paru. Keracunan raksa dapat mengakibatkan beberapa penyakit, antara lain akrodinia (penyakit merah muda), sindrom Hunter–Russell, dan penyakit Minamata.
Gejala biasanya meliputi gangguan sensorik (penglihatan, pendengaran, ucapan), sensasi yang terganggu, dan kurangnya koordinasi. Jenis dan tingkat gejala yang ditunjukkan tergantung pada toksin, dosis, dan metode serta durasi paparan individual. Kajian kasus–kontrol menunjukkan efek seperti tremor, gangguan keterampilan kognitif skills, dan gangguan tidur pada pekerja dengan paparan kronis terhadap uap raksa bahkan pada konsentrasi rendah dalam kisaran 0,7–42 μg/m3.[144][145] Sebuah penelitian telah menunjukkan bahwa paparan akut (4–8 jam) terhadap kadar raksa elemental yang dihitung dari 1,1 hingga 44 mg/m3 akan mengakibatkan nyeri dada, dispnea, batuk, hemoptisis, gangguan fungsi paru, dan bukti pneumonitis interstisial.[146] Paparan akut uap raksa telah terbukti menghasilkan efek sistem saraf pusat yang mendalam, meliputi reaksi psikotik yang ditandai dengan delirium, halusinasi, dan kecenderungan bunuh diri. Paparan pekerjaan telah mengakibatkan gangguan fungsional yang luas, meliputi eretisme, iritabilitas, eksitabilitas, rasa malu yang berlebihan, dan insomnia. Dengan paparan yang terus-menerus, tremor halus akan berkembang dan dapat meningkat menjadi kejang otot yang hebat. Tremor awalnya melibatkan tangan dan kemudian menyebar ke kelopak mata, bibir, dan lidah. Paparan tingkat rendah jangka panjang telah dikaitkan dengan gejala eretisme yang lebih halus, meliputi kelelahan, iritabilitas, kehilangan ingatan, mimpi yang jelas, dan depresi.[147][148]
Perawatan
[sunting | sunting sumber]Penelitian mengenai pengobatan keracunan raksa masih terbatas. Obat yang tersedia saat ini untuk keracunan raksa akut meliputi pengelat N-asetil-D, L-penisilamina (NAP), British Anti-Lewisite (BAL), asam 2,3-dimerkapto-1-propanasulfonat (DMPS), dan asam dimerkaptosuksinat (DMSA). Dalam satu penelitian kecil yang melibatkan 11 pekerja konstruksi yang terpapar raksa elemental, para pasien diobati dengan DMSA dan NAP.[149] Terapi khelasi dengan kedua obat tersebut menghasilkan mobilisasi sebagian kecil dari perkiraan total raksa tubuh. DMSA mampu meningkatkan ekskresi raksa lebih besar daripada NAP.[150]
Peraturan
[sunting | sunting sumber]Internasional
[sunting | sunting sumber]140 negara telah menyetujui Konvensi Minamata mengenai Raksa oleh Program Lingkungan PBB (UNEP) untuk mencegah emisi.[151] Konvensi tersebut ditandatangani pada 10 Oktober 2013.[152]
Amerika Serikat
[sunting | sunting sumber]Di Amerika Serikat, Badan Perlindungan Lingkungan bertugas mengatur dan mengelola kontaminasi raksa. Beberapa undang-undang memberi EPA otoritas ini, meliputi UU Udara Bersih, UU Air Bersih, UU Konservasi dan Pemulihan Sumber Daya, dan UU Air Minum Aman. Selain itu, UU Manajemen Baterai yang Mengandung Raksa dan Dapat Diisi Ulang, disahkan pada tahun 1996, menghapus penggunaan raksa dalam baterai secara bertahap, dan menyediakan pembuangan berbagai jenis baterai bekas yang efisien dan hemat biaya.[153] Amerika Utara menyumbang sekitar 11% dari total emisi raksa antropogenik global pada tahun 1995.[154]
UU Udara Bersih Amerika Serikat, yang disahkan pada tahun 1990, memasukkan raksa ke dalam daftar polutan beracun yang perlu dikendalikan semaksimal mungkin. Dengan demikian, industri yang melepaskan raksa dalam konsentrasi tinggi ke lingkungan setuju untuk memasang teknologi kontrol maksimum yang dapat dicapai (MACT). Pada bulan Maret 2005, EPA mengumumkan sebuah peraturan[155] yang menambahkan pembangkit listrik ke dalam daftar sumber yang harus dikontrol dan menerapkan sistem pembatasan dan perdagangan nasional. Negara-negara bagian diberi waktu hingga November 2006 untuk memberlakukan kontrol yang lebih ketat, tetapi setelah tantangan hukum dari beberapa negara bagian, peraturan tersebut dibatalkan oleh pengadilan banding federal pada tanggal 8 Februari 2008. Aturan tersebut dianggap tidak cukup untuk orang yang tinggal di dekat pembangkit listrik tenaga batu bara, mengingat efek negatif yang didokumentasikan dalam Laporan Penelitian EPA kepada Kongres tahun 1998.[156] Namun, data yang lebih baru yang diterbitkan pada tahun 2015 menunjukkan bahwa setelah pengenalan kontrol yang lebih ketat, tingkat raksa menurun tajam, menunjukkan bahwa UU Udara Bersih memiliki dampak yang diharapkan.[157]
EPA mengumumkan aturan baru untuk pembangkit listrik tenaga batu bara pada 22 Desember 2011.[158] Tanur semen yang membakar limbah berbahaya memiliki standar yang lebih longgar daripada insinerator limbah berbahaya standar di Amerika Serikat, dan akibatnya menjadi sumber polusi raksa yang tidak proporsional.[159]
Uni Eropa
[sunting | sunting sumber]Di Uni Eropa, arahan mengenai Pembatasan Penggunaan Zat Berbahaya Tertentu dalam Peralatan Listrik dan Elektronik (lihat RoHS) melarang raksa dari produk listrik dan elektronik tertentu, dan membatasi jumlah raksa dalam produk lain hingga kurang dari 1000 ppm.[160] Terdapat batasan konsentrasi raksa dalam kemasan (batasannya adalah 100 ppm untuk jumlah total raksa, timbal, kromium heksavalen, dan kadmium) dan baterai (batasannya adalah 5 ppm).[161] Pada Juli 2007, Uni Eropa juga melarang raksa dalam alat ukur non-listrik, seperti termometer dan barometer. Larangan ini hanya berlaku untuk perangkat baru, dan berisi pengecualian untuk sektor perawatan kesehatan dan masa tenggang dua tahun untuk produsen barometer.[162]
Norwegia
[sunting | sunting sumber]Norwegia memberlakukan larangan total penggunaan raksa dalam produksi dan impor/ekspor produk raksa, efektif 1 Januari 2008.[163] Pada tahun 2002, beberapa danau di Norwegia ditemukan memiliki polusi raksa yang buruk, dengan kelebihan 1 μg/g raksa dalam sedimennya.[164] Pada tahun 2008, Menteri Pengembangan Lingkungan Norwegia Erik Solheim mengatakan: "Raksa adalah salah satu racun lingkungan yang paling berbahaya. Tersedia alternatif yang memuaskan untuk Hg dalam produk, dan oleh karena itu sepatutnya semakin mendorong pelarangan ini."[165]
Swedia
[sunting | sunting sumber]Produk yang mengandung raksa dilarang di Swedia pada tahun 2009.[166][167]
Denmark
[sunting | sunting sumber]Pada tahun 2008, Denmark juga melarang amalgam raksa gigi,[165] kecuali tambalan permukaan pengunyah geraham pada gigi permanen (dewasa).
Raksa dalam seni
[sunting | sunting sumber]Air Mancur Raksa, patung Alexander Calder tahun 1937, dipajang di balik kaca di Fundació Joan Miró di Barcelona, untuk mengendalikan uap raksa beracun.[168]
Cloud Gate, sebuah patung publik tahun 2006 oleh Anish Kapoor di Chicago, Illinois, terinspirasi oleh raksa cair.
Lihat pula
[sunting | sunting sumber]- Polusi raksa di samudra
- Raksa merah
- Proses COLEX (pemisahan isotop)
Referensi
[sunting | sunting sumber]- ^ (Indonesia) "Raksa". KBBI Daring. Diakses tanggal 17 Juli 2022.
- ^ (Indonesia) "Merkuri". KBBI Daring. Diakses tanggal 17 Juli 2022.
- ^ "Magnetic Susceptibility of the Elements And Inorganic Compounds" (PDF). www-d0.fnal.gov. Fermi National Accelerator Laboratory: DØ Experiment (lagacy document). Diarsipkan dari versi asli (PDF) tanggal 24 Maret 2004. Diakses tanggal 2 Agustus 2022.
- ^ Weast, Robert (1984). CRC, Handbook of Chemistry and Physics. Boca Raton, Florida: Chemical Rubber Company Publishing. hlm. E110. ISBN 0-8493-0464-4.
- ^ "Definition of hydrargyrum | Dictionary.com". Diarsipkan dari versi asli tanggal 12 Agustus 2014. Diakses tanggal 4 Juli 2023. Random House Webster's Unabridged Dictionary.
- ^ Guzmán-Maldonado, H.; Paredes-López, O. (September 1995). "Amylolytic enzymes and products derived from starch: a review". Critical Reviews in Food Science and Nutrition. 35 (5): 373–403. doi:10.1080/10408399509527706. PMID 8573280.
- ^ Palacios-Fonseca, A.J.; Castro-Rosas, J.; Gómez-Aldapa, C.A.; Tovar-Benítez, T.; Millán-Malo, B.M.; del Real, A.; Rodríguez-García, M.E. (2002-06-25). "Effect of the alkaline and acid treatments on the physicochemical properties of corn starch". CyTA – Journal of Food. 11 (sup1): 67–74. doi:10.1080/19476337.2012.761651.
- ^ "New 12-sided pound coin to enter circulation in March". BBC News. 1 Januari 2017. Diakses tanggal 4 Juli 2023.
- ^ a b c d e f Hammond, C. R. "The Elements" (PDF). Diarsipkan dari versi asli (PDF) tanggal 26 Juni 2008. in Lide, D. R., ed. (2005). CRC Handbook of Chemistry and Physics (edisi ke-86). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5.
- ^ Senese, F. "Why is mercury a liquid at STP?". General Chemistry Online at Frostburg State University. Diarsipkan dari versi asli tanggal 4 April 2007. Diakses tanggal 4 Juli 2023.
- ^ a b Norrby, L.J. (1991). "Why is mercury liquid? Or, why do relativistic effects not get into chemistry textbooks?". Journal of Chemical Education. 68 (2): 110. Bibcode:1991JChEd..68..110N. doi:10.1021/ed068p110.
- ^ Lide, D. R., ed. (2005). CRC Handbook of Chemistry and Physics (edisi ke-86). Boca Raton (FL): CRC Press. hlm. 4.125–4.126. ISBN 0-8493-0486-5.
- ^ "Dynamic Periodic Table". www.ptable.com. Diarsipkan dari versi asli tanggal 20 November 2016. Diakses tanggal 4 Juli 2023.
- ^ Simons, E. N. (1968). Guide to Uncommon Metals. Frederick Muller. hlm. 111.
- ^ Holman, Jack P. (2002). Heat Transfer (edisi ke-9th). New York, NY: cGraw-Hill Companies, Inc. hlm. 600–606. ISBN 9780072406559.
- ^ Incropera 1 Dewitt 2 Bergman 3 Lavigne 4, Frank P. 1 David P. 2 Theodore L. 3 Adrienne S. 4 (2007). Fundamentals of Heat and Mass Transfer (edisi ke-6). Hoboken, NJ: John Wiley and Sons, Inc. hlm. 941–950. ISBN 9780471457282.
- ^ a b Greenwood, Norman N.; Earnshaw, A. (1997), Chemistry of the Elements (edisi ke-2), Oxford: Butterworth-Heinemann, ISBN 0-7506-3365-4
- ^ Gmelin, Leopold (1852). Hand book of chemistry. Cavendish Society. hlm. 103 (Na), 110 (W), 122 (Zn), 128 (Fe), 247 (Au), 338 (Pt). Diarsipkan dari versi asli tanggal 9 Mei 2013. Diakses tanggal 30 December 2012.
- ^ Soratur (2002). Essentials of Dental Materials. Jaypee Brothers Publishers. hlm. 14. ISBN 978-81-7179-989-3. Diarsipkan dari versi asli tanggal 3 Juni 2016.
- ^ Vargel, C.; Jacques, M.; Schmidt, M. P. (2004). Corrosion of Aluminium. Elsevier. hlm. 158. ISBN 9780080444956.
- ^ a b Stillman, J. M. (2003). Story of Alchemy and Early Chemistry. Kessinger Publishing. hlm. 7–9. ISBN 978-0-7661-3230-6.[pranala nonaktif permanen]
- ^ "Mercury – Element information, properties and uses | Periodic Table". www.rsc.org. Diakses tanggal 4 Juli 2023.
- ^ "Mercury and the environment — Basic facts". Environment Canada, Federal Government of Canada. 2004. Diarsipkan dari versi asli tanggal 16 September 2011. Diakses tanggal 4 Juli 2023.
- ^ "Mercury — Element of the ancients". Center for Environmental Health Sciences, Dartmouth College. Diarsipkan dari versi asli tanggal 2 December 2012. Diakses tanggal 4 Juli 2023.
- ^ "Qin Shihuang". Ministry of Culture, People's Republic of China. 2003. Diarsipkan dari versi asli tanggal 4 Juli 2008. Diakses tanggal 4 Juli 2023.
- ^ Wright, David Curtis (2001). The History of China
 . Greenwood Publishing Group. hlm. 49. ISBN 9780313309403.
. Greenwood Publishing Group. hlm. 49. ISBN 9780313309403.
- ^ Sobernheim, Moritz (1987). "Khumārawaih". Dalam Houtsma, Martijn Theodoor. E.J. Brill's first encyclopaedia of Islam, 1913–1936, Volume IV: 'Itk–Kwaṭṭa. Leiden: BRILL. hlm. 973. ISBN 978-90-04-08265-6. Diarsipkan dari versi asli tanggal 3 Juni 2016.
- ^ a b Yuhas, Alan (24 April 2015). "Liquid mercury found under Mexican pyramid could lead to king's tomb". The Guardian. Diarsipkan dari versi asli tanggal 1 Desember 2016. Diakses tanggal 4 Juli 2023.
- ^ Hicks, R. D. (1907). Aristotle De Anima. Chapter 3.
- ^ Pendergast, David M. (6 Agustus 1982). "Ancient maya mercury". Science. 217 (4559): 533–535. Bibcode:1982Sci...217..533P. doi:10.1126/science.217.4559.533. PMID 17820542.
- ^ "Lamanai". Diarsipkan dari versi asli tanggal 11 Juni 2011. Diakses tanggal 4 Juli 2023.
- ^ Hesse R W (2007). Jewelrymaking through history. Greenwood Publishing Group. hlm. 120. ISBN 978-0-313-33507-5.
- ^ Eisler, R. (2006). Mercury hazards to living organisms. CRC Press. ISBN 978-0-8493-9212-2.
- ^ Dirk van Delft; Peter Kes (September 2010). "The discovery of superconductivity" (PDF). Physics Today (dalam bahasa Inggris). 63 (9): 38–43. Bibcode:2010PhT....63i..38V. doi:10.1063/1.3490499
 . ISSN 0031-9228. Wikidata Q55869044.
. ISSN 0031-9228. Wikidata Q55869044.
- ^ Ehrlich, H. L.; Newman D. K. (2008). Geomicrobiology. CRC Press. hlm. 265. ISBN 978-0-8493-7906-2.
- ^ Rytuba, James J (2003). "Mercury from mineral deposits and potential environmental impact". Environmental Geology. 43 (3): 326–338. doi:10.1007/s00254-002-0629-5.
- ^ a b "Metacinnabar: Mineral information, data and localities".
- ^ "Mercury Recycling in the United States in 2000" (PDF). USGS. Diarsipkan dari versi asli (PDF) tanggal 26 Maret 2009. Diakses tanggal 4 Juli 2023.
- ^ Burkholder, M.; Johnson, L. (2008). Colonial Latin America. Oxford University Press. hlm. 157–159. ISBN 978-0-19-504542-0.
- ^ Jamieson, R W (2000). Domestic Architecture and Power. Springer. hlm. 33. ISBN 978-0-306-46176-7.
- ^ Brooks, W. E. (2007). "Mercury" (PDF). U.S. Geological Survey. Diarsipkan dari versi asli (PDF) tanggal 27 Mei 2008. Diakses tanggal 4 Juli 2023.
- ^ Sheaffer, Kristin N. (2023) Mercury. USGS
- ^ About the Mercury Rule Diarsipkan 1 Mei 2012 di Wayback Machine.. Act.credoaction.com (21 Desember 2011). Diakses tanggal 4 Juli 2023.
- ^ a b Sheridan, M. (3 Mei 2009). "'Green' Lightbulbs Poison Workers: hundreds of factory staff are being made ill by mercury used in bulbs destined for the West". The Sunday Times (of London, UK). Diarsipkan dari versi asli tanggal 17 Mei 2009.
- ^ Boulland M (2006). New Almaden. Arcadia Publishing. hlm. 8. ISBN 978-0-7385-3131-1.
- ^ Untuk gambaran umum, lihat Riedel, S.; Kaupp, M. (2009). "The Highest Oxidation States of the Transition Metal Elements". Coordination Chemistry Reviews. 253 (5–6): 606–624. doi:10.1016/j.ccr.2008.07.014.
Sintesis 1976 yang diklaim adalah Deming, Richard L.; Allred, A. L.; Dahl, Alan R.; Herlinger, Albert W.; Kestner, Mark O. (July 1976). "Tripositive mercury. Low temperature electrochemical oxidation of 1,4,8,11-tetraazacyclotetradecanemercury(II) tetrafluoroborate". Journal of the American Chemical Society. 98 (14): 4132–4137. doi:10.1021/ja00430a020; tetapi perhatikan bahwa Reidel & Kaupp mengutip karya yang lebih baru dengan alasan bahwa ligan siklam justru teroksidasi.
Isolasi 2007 yang diklaim adalah Xuefang Wang; Andrews, Lester; Riedel, Sebastian; Kaupp, Martin (2007). "Mercury Is a Transition Metal: The First Experimental Evidence for HgF4". Angew. Chem. Int. Ed. 46 (44): 8371–8375. doi:10.1002/anie.200703710. PMID 17899620, tetapi identifikasi spektrum diperdebatkan dalam Rooms, J. F.; Wilson, A. V.; Harvey, I.; Bridgeman, A. J.; Young, N. A. (2008). "Mercury-fluorine interactions: a matrix isolation investigation of Hg⋯F2, HgF2 and HgF4 in argon matrices". Phys Chem Chem Phys. 10 (31): 4594–605. Bibcode:2008PCCP...10.4594R. doi:10.1039/b805608k. PMID 18665309.
- ^ Henderson, W. (2000). Main group chemistry. Great Britain: Royal Society of Chemistry. hlm. 162. ISBN 978-0-85404-617-1. Diarsipkan dari versi asli tanggal 13 Mei 2016.
- ^ Brown, I. D.; Gillespie, R. J.; Morgan, K. R.; Tun, Z.; Ummat, P. K. (1984). "Preparation and crystal structure of mercury hexafluoroniobate (Hg3NbF6) and mercury hexafluorotantalate (Hg3TaF6): mercury layer compounds". Inorganic Chemistry. 23 (26): 4506–4508. doi:10.1021/ic00194a020.
- ^ Rogalski, A (2000). Infrared detectors. CRC Press. hlm. 507. ISBN 978-90-5699-203-3.
- ^ National Research Council (U.S.) – Board on Environmental Studies and Toxicology (2000). Toxicological effects of methylmercury. National Academies Press. ISBN 978-0-309-07140-6.
- ^ Surmann, P; Zeyat, H (November 2005). "Voltammetric analysis using a self-renewable non-mercury electrode". Analytical and Bioanalytical Chemistry. 383 (6): 1009–13. doi:10.1007/s00216-005-0069-7. PMID 16228199.
- ^ Lind, J (1787). "An Account of the Efficacy of Mercury in the Cure of Inflammatory Diseases, and the Dysentery". The London Medical Journal. 8 (Pt 1): 43–56. PMC 5545546
 . PMID 29139904.
. PMID 29139904.
- ^ FDA. "Thimerosal in Vaccines". Food and Drug Administration. Diarsipkan dari versi asli tanggal 26 Oktober 2006. Diakses tanggal 4 Juli 2023.
- ^ Parker SK; Schwartz B; Todd J; Pickering LK (2004). "Thimerosal-containing vaccines and autistic spectrum disorder: a critical review of published original data". Pediatrics. 114 (3): 793–804. CiteSeerX 10.1.1.327.363
 . doi:10.1542/peds.2004-0434. PMID 15342856. Erratum: Parker S, Todd J, Schwartz B, Pickering L (Januari 2005). "Thimerosal-containing vaccines and autistic spectrum disorder: a critical review of published original data". Pediatrics. 115 (1): 200. doi:10.1542/peds.2004-2402. PMID 15630018. .
. doi:10.1542/peds.2004-0434. PMID 15342856. Erratum: Parker S, Todd J, Schwartz B, Pickering L (Januari 2005). "Thimerosal-containing vaccines and autistic spectrum disorder: a critical review of published original data". Pediatrics. 115 (1): 200. doi:10.1542/peds.2004-2402. PMID 15630018. .
- ^ "Thimerosal in vaccines". Center for Biologics Evaluation and Research, U.S. Food and Drug Administration. 6 September 2007. Diarsipkan dari versi asli tanggal 29 September 2007. Diakses tanggal 4 Juli 2023.
- ^ Liu J; Shi JZ; Yu LM; Goyer RA; Waalkes MP (2008). "Mercury in traditional medicines: is cinnabar toxicologically similar to common mercurials?". Exp. Biol. Med. (Maywood). 233 (7): 810–7. doi:10.3181/0712-MR-336. PMC 2755212
 . PMID 18445765.
. PMID 18445765.
- ^ "Two States Pass First-time Bans on Mercury Blood Pressure Devices". Health Care Without Harm. 2 Juni 2003. Diarsipkan dari versi asli tanggal 4 Oktober 2011. Diakses tanggal 4 Juli 2023.
- ^ "Title 21—Food and Drugs Chapter I—Food and Drug Administration Department of Health and Human Services Subchapter D—Drugs for Human Use Code of federal regulations". United States Food and Drug Administration. Diarsipkan dari versi asli tanggal 13 Maret 2007. Diakses tanggal 4 Juli 2023.
- ^ "The CRB Commodity Yearbook (annual)". The CRB Commodity Yearbook: 173. 2000.
- ^ a b Leopold, B. R. (2002). "Chapter 3: Manufacturing Processes Involving Mercury. Use and Release of Mercury in the United States" (PDF). National Risk Management Research Laboratory, Office of Research and Development, U.S. Environmental Protection Agency, Cincinnati, Ohio. Diarsipkan dari versi asli (PDF) tanggal 21 Juni 2007. Diakses tanggal 4 Juli 2023.
- ^ "Chlorine Online Diagram of mercury cell process". Euro Chlor. Diarsipkan dari versi asli tanggal 2 September 2006. Diakses tanggal 4 Juli 2023.
- ^ "Mercury Reduction Act of 2003". United States. Congress. Senate. Committee on Environment and Public Works. Diakses tanggal 4 Juli 2023.
- ^ "Liquid-mirror telescope set to give stargazing a new spin". Govert Schilling. 14 Maret 2003. Diarsipkan dari versi asli tanggal 18 Agustus 2003. Diakses tanggal 4 Juli 2023.
- ^ Gibson, B. K. (1991). "Liquid Mirror Telescopes: History". Journal of the Royal Astronomical Society of Canada. 85: 158. Bibcode:1991JRASC..85..158G.
- ^ "Laval University Liquid mirrors and adaptive optics group". Diarsipkan dari versi asli tanggal 18 September 2011. Diakses tanggal 4 Juli 2023.
- ^ Brans, Y W; Hay W W (1995). Physiological monitoring and instrument diagnosis in perinatal and neonatal medicine. CUP Archive. hlm. 175. ISBN 978-0-521-41951-2.
- ^ Zoski, Cynthia G. (7 Februari 2007). Handbook of Electrochemistry. Elsevier Science. ISBN 978-0-444-51958-0.
- ^ Kissinger, Peter; Heineman, William R. (23 Januari 1996). Laboratory Techniques in Electroanalytical Chemistry, Second Edition, Revised and Expanded (edisi ke-2). CRC. ISBN 978-0-8247-9445-3.
- ^ Hopkinson, G. R.; Goodman, T. M.; Prince, S. R. (2004). A guide to the use and calibration of detector array equipment. SPIE Press. hlm. 125. Bibcode:2004gucd.book.....H. ISBN 978-0-8194-5532-1.
- ^ Howatson A H (1965). "Chapter 8". An Introduction to Gas Discharges. Oxford: Pergamon Press. ISBN 978-0-08-020575-5.
- ^ Milo G E; Casto B C (1990). Transformation of human diploid fibroblasts. CRC Press. hlm. 104. ISBN 978-0-8493-4956-0.
- ^ Shionoya, S. (1999). Phosphor handbook. CRC Press. hlm. 363. ISBN 978-0-8493-7560-6.
- ^ Robert L. Tjoelker; et al. (2016). "Mercury Ion Clock for a NASA Technology Demonstration Mission". IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control. 63 (7): 1034–1043. Bibcode:2016ITUFF..63.1034T. doi:10.1109/TUFFC.2016.2543738. PMID 27019481.
- ^ "Mercury in your eye?". CIDPUSA. 16 Februari 2008. Diarsipkan dari versi asli tanggal 5 Januari 2010. Diakses tanggal 4 Juli 2023.
- ^ McKelvey W; Jeffery N; Clark N; Kass D; Parsons PJ. 2010 (2011). "Population-Based Inorganic Mercury Biomonitoring and the Identification of Skin Care Products as a Source of Exposure in New York City". Environ Health Perspect. 119 (2): 203–9. doi:10.1289/ehp.1002396. PMC 3040607
 . PMID 20923743.
. PMID 20923743.
- ^ Mohammed, Terry; Mohammed, Elisabeth; Bascombe, Shermel (9 Oktober 2017). "The evaluation of total mercury and arsenic in skin bleaching creams commonly used in Trinidad and Tobago and their potential risk to the people of the Caribbean". Journal of Public Health Research. 6 (3): 1097. doi:10.4081/jphr.2017.1097. PMC 5736993
 . PMID 29291194.
. PMID 29291194.
- ^ Senthilingam, Meera. "Exclusive: Skin whitening creams containing high levels of mercury continue to be sold on the world's biggest e-commerce sites, new report finds". CNN. Diakses tanggal 4 Juli 2023.
- ^ Healy, Paul F.; Blainey, Marc G. (2011). "Ancient Maya Mosaic Mirrors: Function, Symbolism, And Meaning". Ancient Mesoamerica. 22 (2): 229–244 (241). doi:10.1017/S0956536111000241.
- ^ Lew K. (2008). Mercury. The Rosen Publishing Group. hlm. 10. ISBN 978-1-4042-1780-5.
- ^ Pearson L. F. (2003). Lighthouses. Osprey Publishing. hlm. 29. ISBN 978-0-7478-0556-4.
- ^ Ramanathan E. AIEEE Chemistry. Sura Books. hlm. 251. ISBN 978-81-7254-293-1.
- ^ Shelton, C. (2004). Electrical Installations. Nelson Thornes. hlm. 260. ISBN 978-0-7487-7979-6.
- ^ "Popular Science". The Popular Science Monthly. Bonnier Corporation. 118 (3): 40. 1931.
- ^ Mueller, Grover C. (September 1929). Cheaper Power from Quicksilver. Popular Science.
- ^ Mercury as a Working Fluid. Museum of Retro Technology. 13 November 2008. Diarsipkan dari versi asli tanggal 21 Februari 2011.
- ^ Collier (1987). Introduction to Nuclear Power. Taylor & Francis. hlm. 64. ISBN 978-1-56032-682-3.
- ^ "Glenn Contributions to Deep Space 1". NASA. Diarsipkan dari versi asli tanggal 1 Oktober 2009. Diakses tanggal 4 Juli 2023.
- ^ "Electric space propulsion". Diarsipkan dari versi asli tanggal 30 Mei 2009. Diakses tanggal 4 Juli 2023.
- ^ "IMERC Fact Sheet: Mercury Use in Batteries". Northeast Waste Management Officials' Association. Januari 2010. Diarsipkan dari versi asli tanggal 29 November 2012. Diakses tanggal 4 Juli 2023.
- ^ Gray, T. (22 September 2004). "The Amazing Rusting Aluminum". Popular Science. Diarsipkan dari versi asli tanggal 20 Juli 2009. Diakses tanggal 4 Juli 2023.
- ^ a b Dufault, Renee; Leblanc, Blaise; Schnoll, Roseanne; Cornett, Charles; Schweitzer, Laura; Wallinga, David; Hightower, Jane; Patrick, Lyn; Lukiw, Walter J. (2009). "Mercury from Chlor-alkali plants". Environmental Health. 8: 2. doi:10.1186/1476-069X-8-2. PMC 2637263
 . PMID 19171026. Diarsipkan dari versi asli tanggal 29 Juli 2012.
. PMID 19171026. Diarsipkan dari versi asli tanggal 29 Juli 2012.
- ^ Council, World Chlorine (2021). "World Chlorine Council Report to UNEP on Chlor-Alkali Partnership-Data 2020". World Chlorine Council Report.
- ^ Francis, G. W. (1849). Chemical Experiments. D. Francis. hlm. 62.
- ^ Castles, W. T.; Kimball, V. F. (2005). Firearms and Their Use. Kessinger Publishing. hlm. 104. ISBN 978-1-4179-8957-7.
- ^ Lee, J. D. (1999). Concise Inorganic Chemistry. Wiley-Blackwell. ISBN 978-0-632-05293-6.
- ^ Waldron, H. A. (1983). "Did the Mad Hatter have mercury poisoning?". Br. Med. J. (Clin. Res. Ed.). 287 (6409): 1961. doi:10.1136/bmj.287.6409.1961. PMC 1550196
 . PMID 6418283.
. PMID 6418283.
- ^ Alpers, C. N.; Hunerlach, M. P.; May, J. Y.; Hothem, R. L. "Mercury Contamination from Historical Gold Mining in California". U.S. Geological Survey. Diarsipkan dari versi asli tanggal 22 Februari 2008. Diakses tanggal 4 Juli 2023.
- ^ "Mercury amalgamation". Corrosion Doctors. Diarsipkan dari versi asli tanggal 19 Mei 2009. Diakses tanggal 4 Juli 2023.
- ^ Pimple, K. D.; Pedroni, J. A.; Berdon, V. (9 Juli 2002). "Syphilis in history". Poynter Center for the Study of Ethics and American Institutions at Indiana University-Bloomington. Diarsipkan dari versi asli tanggal 16 Februari 2005. Diakses tanggal 4 Juli 2023.
- ^ Mayell, H. (17 Juli 2007). "Did Mercury in "Little Blue Pills" Make Abraham Lincoln Erratic?". National Geographic News. Diarsipkan dari versi asli tanggal 22 Mei 2008. Diakses tanggal 4 Juli 2023.
- ^ "What happened to Mercurochrome?". 23 Juli 2004. Diarsipkan dari versi asli tanggal 11 April 2009. Diakses tanggal 4 Juli 2023.
- ^ "Mercury 294594". Sigma-Aldrich.
- ^ "Mercury: Spills, Disposal and Site Cleanup". Environmental Protection Agency. Diarsipkan dari versi asli tanggal 13 Mei 2008. Diakses tanggal 4 Juli 2023.
- ^ Dufault, Renee J.; Wolle, Mesay M.; Kingston, H. M. Skip; Gilbert, Steven G.; Murray, Joseph A. (20 Juli 2021). "Connecting inorganic mercury and lead measurements in blood to dietary sources of exposure that may impact child development". World Journal of Methodology. 11 (4): 144–159. doi:10.5662/wjm.v11.i4.144. PMC 8299913
 Periksa nilai
Periksa nilai |pmc=(bantuan). PMID 34322366 Periksa nilai|pmid=(bantuan). - ^ Saghazadeh, Amene; Rezaei, Nima (3 Oktober 2017). "Systematic review and meta-analysis links autism and toxic metals and highlights the impact of country development status: Higher blood and erythrocyte levels for mercury and lead, and higher hair antimony, cadmium, lead, and mercury". Progress in Neuro-Psychopharmacology and Biological Psychiatry. 79 (Pt B): 340–368. doi:10.1016/j.pnpbp.2017.07.011. PMID 28716727.
- ^ Shah-Kulkarni, Surabhi; Lee, Seulbi; Jeong, Kyoung Sook; Hong, Yun-Chul; Park, Hyesook; Ha, Mina; Kim, Yangho; Ha, Eun-Hee (1 Maret 2020). "Prenatal exposure to mixtures of heavy metals and neurodevelopment in infants at 6 months". Environmental Research. 182: 109122. Bibcode:2020ER....182j9122S. doi:10.1016/j.envres.2020.109122. PMID 32069757.
- ^ He, Ka; Xun, Pengcheng; Liu, Kiang; Morris, Steve; Reis, Jared; Guallar, Eliseo (15 Mei 2016). "Mercury Exposure in Young Adulthood and Incidence of Diabetes Later in Life". Diabetes Care. 36 (6): 1584–1589. doi:10.2337/dc12-1842. PMC 3661833
 . PMID 23423697.
. PMID 23423697.
- ^ Tsai, Tsung-Lin; Kuo, Chin-Chi; Pan, Wen-Harn; Wu, Trong-Neng; Lin, Pinpin; Wang, Shu-Li (1 Mei 2019). "Type 2 diabetes occurrence and mercury exposure – From the National Nutrition and Health Survey in Taiwan". Environment International. 126: 260–267. doi:10.1016/j.envint.2019.02.038. PMID 30825744.
- ^ "Baby Foods Are Tainted with Dangerous Levels of Arsenic, Lead, Cadmium, and Mercury" (PDF). US House of Representatives Staff Report. 4 Februari 2021.
- ^ "Statement: New congressional report paints scary picture of toxic metals in baby food". PIRG. Diakses tanggal 4 Juli 2023.
- ^ "New government report finds "toxic heavy metals" like arsenic and mercury in popular baby foods". www.cbsnews.com. Diakses tanggal 4 Juli 2023.
- ^ Dufault, Renee; Schnoll, Roseanne; Lukiw, Walter J.; Leblanc, Blaise; Cornett, Charles; Patrick, Lyn; Wallinga, David; Gilbert, Steven G.; Crider, Raquel (27 Oktober 2009). "Mercury exposure, nutritional deficiencies and metabolic disruptions may affect learning in children". Behavioral and Brain Functions: BBF. 5: 44. doi:10.1186/1744-9081-5-44. PMC 2773803
 . PMID 19860886.
. PMID 19860886.
- ^ Dufault, Renee; Schnoll, Roseanne; Lukiw, Walter J.; Leblanc, Blaise; Cornett, Charles; Patrick, Lyn; Wallinga, David; Gilbert, Steven G.; Crider, Raquel (27 Oktober 2009). "Mercury exposure, nutritional deficiencies and metabolic disruptions may affect learning in children". Behavioral and Brain Functions: BBF. 5: 44. doi:10.1186/1744-9081-5-44. PMC 2773803
 . PMID 19860886.
. PMID 19860886.
- ^ "Glacial Ice Cores Reveal A Record of Natural and Anthropogenic Atmospheric Mercury Deposition for the Last 270 Years". United States Geological Survey (USGS). Diarsipkan dari versi asli tanggal 4 Juli 2007. Diakses tanggal 4 Juli 2023.
- ^ a b c Pacyna E G; Pacyna J M; Steenhuisen F; Wilson S (2006). "Global anthropogenic mercury emission inventory for 2000". Atmos Environ. 40 (22): 4048. Bibcode:2006AtmEn..40.4048P. doi:10.1016/j.atmosenv.2006.03.041.
- ^ "What is EPA doing about mercury air emissions?". United States Environmental Protection Agency (EPA). Diarsipkan dari versi asli tanggal 8 Februari 2007. Diakses tanggal 4 Juli 2023.
- ^ Solnit, R. (September–Oktober 2006). "Winged Mercury and the Golden Calf". Orion Magazine. Diarsipkan dari versi asli tanggal 5 Oktober 2007. Diakses tanggal 4 Juli 2023.
- ^ Maprani, Antu C.; Al, Tom A.; MacQuarrie, Kerry T.; Dalziel, John A.; Shaw, Sean A.; Yeats, Phillip A. (2005). "Determination of Mercury Evasion in a Contaminated Headwater Stream". Environmental Science & Technology. 39 (6): 1679–87. Bibcode:2005EnST...39.1679M. doi:10.1021/es048962j. PMID 15819225.
- ^ "Indoor Air Mercury" (PDF). newmoa.org. Mei 2003. Diarsipkan dari versi asli (PDF) tanggal 25 Maret 2009. Diakses tanggal 4 Juli 2023.
- ^ Meissner, Dirk (12 Mei 2015). "West Moberly First Nations concerned about mercury contamination in fish". CBC News. The Canadian Press. Diakses tanggal 4 Juli 2023.
- ^ "Williston-Dinosaur Watershed Fish Mercury Investigation: 2017 Report" (PDF). Fish and Wildlife Compensation Program, Peace Region. Juni 2018. Diakses tanggal 4 Juli 2023.
- ^ Schuster, Paul; Schaefer, Kevin; Aiken, George; Antweiler, Ronald; Dewild, John; et al. (2018). "Permafrost Stores a Globally Significant Amount of Mercury". Geophysical Research Letters. 45 (3): 1463–1471. Bibcode:2018GeoRL..45.1463S. doi:10.1002/2017GL075571
 .
.
- ^ St. Pierre, Kyra A.; Zolkos, Scott; Shakil, Sarah; Tank, Suzanne E.; St. Louis, Vincent L.; Kokelj, Steven V. (18 December 2018). "Unprecedented Increases in Total and Methyl Mercury Concentrations Downstream of Retrogressive Thaw Slumps in the Western Canadian Arctic". Environmental Science & Technology. 52 (24): 14099–14109. Bibcode:2018EnST...5214099S. doi:10.1021/acs.est.8b05348. PMID 30474969.
- ^ Ci, Zhijia; Peng, Fei; Xue, Xian; Zhang, Xiaoshan (5 Mei 2020). "Permafrost Thaw Dominates Mercury Emission in Tibetan Thermokarst Ponds". Environmental Science & Technology. 54 (9): 5456–5466. Bibcode:2020EnST...54.5456C. doi:10.1021/acs.est.9b06712. PMID 32294379.
- ^ "Mercury-containing Products". United States Environmental Protection Agency (EPA). Diarsipkan dari versi asli tanggal 12 Februari 2007. Diakses tanggal 4 Juli 2023.
- ^ IMERC Fact Sheet – Mercury Use in Thermostats Diarsipkan 17 Juni 2012 di Wayback Machine. Januari 2010
- ^ Shen, Huazhen; Tsai, Cheng-Mou; Yuan, Chung-Shin; Jen, Yi-Hsiu; Ie, Iau-Ren (2017). "How incense and joss paper burning during the worship activities influences ambient mercury concentrations in indoor and outdoor environments of an Asian temple?". Chemosphere. 167: 530–540. Bibcode:2017Chmsp.167..530S. doi:10.1016/j.chemosphere.2016.09.159. PMID 27764746.
- ^ Lin, Chunshui; Huang, Ru-Jin; Duan, Jing; Zhong, Haobin; Xu, Wei; Wu, Yunfei; Zhang, Renjian (2022). "Large contribution from worship activities to the atmospheric soot particles in northwest China". Environmental Pollution. 299: 118907. doi:10.1016/j.envpol.2022.118907. PMID 35091017 Periksa nilai
|pmid=(bantuan). - ^ "Parkinson's disease in occupational exposure to joss paper, a report of two cases".
- ^ "Introduction". United States Department of Energy. Diarsipkan dari versi asli tanggal 8 July 2007.
- ^ "Minamata Disease The History and Measures". Ministry of the Environment, Government of Japan. Diarsipkan dari versi asli tanggal 24 Juni 2009. Diakses tanggal 4 Juli 2023.
- ^ Dennis Normile (27 September 2013). "In Minamata, Mercury Still Divides". Science. 341 (6153): 1446–7. Bibcode:2013Sci...341.1446N. doi:10.1126/science.341.6153.1446. PMID 24072902.
- ^ Pourkhabbaz, A.; Pourkhabbaz, H. (2012). "Investigation of Toxic Metals in the Tobacco of Different Iranian Cigarette Brands and Related Health Issues". Iranian Journal of Basic Medical Sciences. 15 (1): 636–644. PMC 3586865
 . PMID 23493960.
. PMID 23493960.
- ^ Talhout, Reinskje; Schulz, Thomas; Florek, Ewa; Van Benthem, Jan; Wester, Piet; Opperhuizen, Antoon (2011). "Hazardous Compounds in Tobacco Smoke". International Journal of Environmental Research and Public Health. 8 (12): 613–628. doi:10.3390/ijerph8020613
 . PMC 3084482
. PMC 3084482  . PMID 21556207.
. PMID 21556207.
- ^ Bernhard, David, Rossmann, Andrea, Wick, Georg (2005). "Metals in Cigarette Smoke". IUBMB Life. 57 (12): 805–809. doi:10.1080/15216540500459667
 . PMID 16393783.
. PMID 16393783.
- ^ a b c Vane, Christopher H.; Beriro, Darren J.; Turner, Grenville H. (2015). "Rise and fall of mercury (Hg) pollution in sediment cores of the Thames Estuary, London, UK". Earth and Environmental Science Transactions of the Royal Society of Edinburgh. 105 (4): 285–296. doi:10.1017/S1755691015000158
 .
.
- ^ Vane, C.H.; Jones, D.G.; Lister, T.R. (2009). "Mercury contamination in surface sediments and sediment cores of the Mersey Estuary, UK" (PDF). Marine Pollution Bulletin. 58 (6): 940–946. Bibcode:2009MarPB..58..940V. doi:10.1016/j.marpolbul.2009.03.006. PMID 19356771.
- ^ Vane, C.H.; Harrison, I.; Kim, A.W.; Moss-Hayes, V.; Vickers, B.P.; Horton, B.P. (2008). "Status of organic pollutants in surface sediments of Barnegat Bay-Little Egg Harbor Estuary, New Jersey, USA" (PDF). Marine Pollution Bulletin. 56 (10): 1802–1808. Bibcode:2008MarPB..56.1802V. doi:10.1016/j.marpolbul.2008.07.004. PMID 18715597.
- ^ Vane, C.H.; Harrison, I.; Kim, A.W.; Moss-Hayes, V.; Vickers, B.P.; Hong, K. (2009). "Organic and metal contamination in surface mangrove sediments of South China" (PDF). Marine Pollution Bulletin. 58 (1): 134–144. Bibcode:2009MarPB..58..134V. doi:10.1016/j.marpolbul.2008.09.024. PMID 18990413.
- ^ Cocoros, Glenn; Cahn, Phyllis H.; Siler, William (November 1973). "Mercury concentrations in fish, plankton and water from three Western Atlantic estuaries". Journal of Fish Biology. 5 (6): 641–647. doi:10.1111/j.1095-8649.1973.tb04500.x.
- ^ "How We Do Things at IISD-ELA: Collecting a fish muscle biopsy". IISD. 30 September 2015. Diakses tanggal 4 Juli 2023.
- ^ Mole, Beth (20 Desember 2019). "Woman had 524x the normal level of mercury in her blood from skin cream use". ArsTechnica. Diakses tanggal 4 Juli 2023.
- ^ Mudan, Anita, Copan L, Wang R, et al. (20 December 2019). "Notes from the Field: Methylmercury Toxicity from a Skin Lightening Cream Obtained from Mexico — California, 2019". Morbidity and Mortality Weekly Report. 68 (50): 1166–1167. doi:10.15585/mmwr.mm6850a4. PMC 6936160
 . PMID 31856147.
. PMID 31856147.
- ^ Ngim, CH; Foo, SC; Boey, K.W.; Keyaratnam, J (1992). "Chronic neurobehavioral effects of elemental mercury in dentists". British Journal of Industrial Medicine. 49 (11): 782–90. doi:10.1136/oem.49.11.782. PMC 1039326
 . PMID 1463679.
. PMID 1463679.
- ^ Liang, Y. X.; Sun, R. K.; Sun, Y.; Chen, Z. Q.; Li, L. H. (1993). "Psychological effects of low exposure to mercury vapor: Application of computer-administered neurobehavioral evaluation system". Environmental Research. 60 (2): 320–7. Bibcode:1993ER.....60..320L. doi:10.1006/enrs.1993.1040. PMID 8472661.
- ^ McFarland, RB; Reigel, H (1978). "Chronic Mercury Poisoning from a Single Brief Exposure". J. Occup. Med. 20 (8): 532–4. doi:10.1097/00043764-197808000-00003. PMID 690736.
- ^ Mercury, Environmental Health Criteria monograph No. 001, Jenewa: Organisasi Kesehatan Dunia, 1976, ISBN 92-4-154061-3
- ^ Inorganic mercury, Environmental Health Criteria monograph No. 118, Jenewa: Organisasi Kesehatan Dunia, 1991, ISBN 92-4-157118-7
- ^ Bluhm, RE; et al. (1992). "Elemental Mercury Vapour Toxicity, Treatment, and Prognosis After Acute, Intensive Exposure in Chloralkali Plant Workers. Part I: History, Neuropsychological Findings and Chelator effects". Hum Exp Toxicol. 11 (3): 201–10. doi:10.1177/096032719201100308. PMID 1352115.
- ^ Bluhm, Re; Bobbitt, Rg; Welch, Lw; Wood, Aj; Bonfiglio, Jf; Sarzen, C; Heath, Aj; Branch, Ra (1992). "Elemental mercury vapour toxicity, treatment, and prognosis after acute, intensive exposure in chloralkali plant workers. Part I: History, neuropsychological findings and chelator effects". Human & Experimental Toxicology. 11 (3): 201–10. doi:10.1177/096032719201100308. PMID 1352115.
- ^ "Minamata Convention Agreed by Nations". Program Lingkungan Perserikatan Bangsa-Bangsa. Diarsipkan dari versi asli tanggal 30 Januari 2013. Diakses tanggal 4 Juli 2023.
- ^ Section, United Nations News Service (19 Januari 2013). "UN News — Governments at UN forum agree on legally-binding treaty to curb mercury pollution". UN News Service Section. Diarsipkan dari versi asli tanggal 16 Oktober 2016. Diakses tanggal 4 Juli 2023.
- ^ "Mercury: Laws and regulations". United States Environmental Protection Agency. 16 April 2008. Diarsipkan dari versi asli tanggal 13 Mei 2008. Diakses tanggal 4 Juli 2023.
- ^ "Reductions in Mercury Emissions". International Joint Commission on the Great Lakes. Diarsipkan dari versi asli tanggal 28 Agustus 2008. Diakses tanggal 4 Juli 2023.
- ^ "Clean Air Mercury Rule". United States Environmental Protection Agency (EPA). Diarsipkan dari versi asli tanggal 30 Juni 2007. Diakses tanggal 4 Juli 2023.
- ^ "State of New Jersey et al., Petitioners vs. Environmental Protection Agency (Case No. 05-1097)" (PDF). United States Court of Appeals for the District of Columbia Circuit. Argumen 6 Desember 2007, Diputuskan 8 Februari 2008. Diarsipkan dari versi asli (PDF) tanggal 3 Februari 2011. Diakses tanggal 4 Juli 2023.
- ^ Castro Mark S., Sherwell John (2015). "Effectiveness of Emission Controls to Reduce the Atmospheric Concentrations of Mercury". Environmental Science & Technology. 49 (24): 14000–14007. Bibcode:2015EnST...4914000C. doi:10.1021/acs.est.5b03576. PMID 26606506.
- ^ "Oldest, dirtiest power plants told to clean up". Boston Globe. 22 Desember 2011. Diarsipkan dari versi asli tanggal 14 Juli 2014. Diakses tanggal 4 Juli 2023.
- ^ Howard Berkes (10 November 2011). "EPA Regulations Give Kilns Permission To Pollute". NPR. Diarsipkan dari versi asli tanggal 17 November 2011. Diakses tanggal 4 Juli 2023.
- ^ "Directive 2002/95/EC on the Restriction of the Use of Certain Hazardous Substances in Electrical and Electronic Equipment". 27 Januari 2003. Pasal 4 Ayat 1. mis. “Negara Anggota harus memastikan bahwa, mulai 1 Juli 2006, peralatan listrik dan elektronik baru yang dipasarkan tidak mengandung timbal, raksa, cadmium, kadmium, kromium heksavalen, bifenil terpolibrominasi (PBB) difenil eter terpolibrominasi (PBDE)."
- ^ "Mercury compounds in European Union". EIA Track. 2007. Diarsipkan dari versi asli tanggal 28 April 2008. Diakses tanggal 4 Juli 2023.
- ^ Jones H. (10 Juli 2007). "EU bans mercury in barometers, thermometers". Reuters. Diarsipkan dari versi asli tanggal 3 Januari 2009. Diakses tanggal 4 Juli 2023.
- ^ "Norway to ban mercury". EU Business. 21 Desember 2007. Diarsipkan dari versi asli tanggal 21 Januari 2008. Diakses tanggal 4 Juli 2023.
- ^ Berg, T; Fjeld, E; Steinnes, E (2006). "Atmospheric mercury in Norway: contributions from different sources". The Science of the Total Environment. 368 (1): 3–9. Bibcode:2006ScTEn.368....3B. doi:10.1016/j.scitotenv.2005.09.059. PMID 16310836.
- ^ a b Edlich, Richard F; Rhoads, Samantha K.; Cantrell, Holly S.; Azavedo, Sabrina M.; Newkirk, Anthony T. "Banning Mercury Amalgam in the United States" (PDF). AS: Food and Drug Administration. Diarsipkan dari versi asli (PDF) tanggal 1 November 2013.
- ^ "Sweden to ban mercury — The Local". 14 Januari 2009. Diarsipkan dari versi asli tanggal 28 Agustus 2016. Diakses tanggal 4 Juli 2023.
- ^ "Sweden may be forced to lift ban on mercury — The Local". 21 April 2012. Diarsipkan dari versi asli tanggal 28 Agustus 2016. Diakses tanggal 4 Juli 2023.
- ^ Jessop, Tara (8 Agustus 2016). "Calder Mercury Fountain: The World's Most Beautiful Yet Deadly Monument". Culture Trip. Diakses tanggal 4 Juli 2023.
Bacaan lebih lanjut
[sunting | sunting sumber]- Johnston, Andrew Scott (15 September 2013). Mercury and the Making of California: Mining, Landscape, and Race, 1840–1890. TotalBoox, TBX. University Press of Colorado. ISBN 9781457183997. OCLC 969039240.
Daftar pustaka
[sunting | sunting sumber]- Herman DZ (2006). "Tinjauan terhadap tailing mengandung unsur pencemar As, Hg, Pb, dan Cd". J Geol Indones. 1: 31–36.
- Klaassen CD, Amdur MO, Doull J (1986). Toxicology The Basic Science of Poisons. New York: Macmillan Publishing Company.
- Palar H (1994). Pencemaran dan Toksikologi Logam Berat. Jakarta: Rineka cipta.
- Widowati W, Sastiono A, Jusuf R (2008). Efek Toksik logam Pencegahan dan Penanggulangan Pencemaran. Yogyakarta: Andi. ISBN 978-979-29-0448-2.
Pranala luar
[sunting | sunting sumber]- (Inggris) Chemistry in its element podcast (MP3) from the Royal Society of Chemistry's Chemistry World: Mercury
- (Inggris) Mercury di The Periodic Table of Videos (Universitas Nottingham)
- (Inggris) Centers for Disease Control and Prevention – Mercury Topic
- (Inggris) EPA fish consumption guidelines
- (Inggris) Hg 80 Mercury
- (Inggris) Material Safety Data Sheet – Mercury
- (Inggris) Stopping Pollution: Mercury – Oceana
- (Inggris) Natural Resources Defense Council (NRDC): Mercury Contamination in Fish guide – NRDC
- (Inggris) NLM Hazardous Substances Databank – Mercury
- (Inggris) BBC – Earth News – Mercury "turns" wetland birds such as ibises homosexual
- (Inggris) Changing Patterns in the Use, Recycling, and Material Substitution of Mercury in the United States United States Geological Survey
- (Inggris) Thermodynamical data on liquid mercury.
- (Inggris)
 "Mercury (element)". Encyclopædia Britannica (edisi ke-11). 1911.
"Mercury (element)". Encyclopædia Britannica (edisi ke-11). 1911.
| (besar) | |||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||||||
| 1 | H | He | |||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |
|
| |||||||||||||||||||||||||||||||||