Rzekotka drzewna
| Hyla arborea[1] | |||
| (Linnaeus, 1758) | |||

| |||
| Systematyka | |||
| Domena | |||
|---|---|---|---|
| Królestwo | |||
| Typ | |||
| Podtyp | |||
| Gromada | |||
| Rząd | |||
| Podrząd | |||
| Rodzina | |||
| Rodzaj | |||
| Gatunek |
rzekotka drzewna | ||
| Synonimy | |||
| |||
| Kategoria zagrożenia (CKGZ)[2] | |||
 | |||
| Zasięg występowania | |||
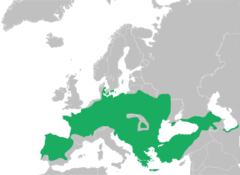 Mapa zasięgu występowania według IUCN[2] | |||
Rzekotka drzewna (Hyla arborea) – gatunek płaza z rodziny rzekotkowatych (Hylidae).
Osiąga około 5 cm długości. Cechuje się zwykle zielonym, szarym, brązowym lub żółtawym ubarwieniem, które potrafi zmieniać w zależności od otoczenia. Boki ciała rzekotki zdobi charakterystyczna ciemna pręga, odgrywająca obok rechotu rolę w doborze płciowym. Oczy są duże, wyłupiaste, kończyny tylne długie, opuszki palców wieńczą przylgi ułatwiające wspinaczkę po drzewach.
Płaz zamieszkuje duże obszary Europy, od Portugalii aż do krańców kontynentu i zachodniej Azji (Azerbejdżan), na północy sięga Danii. Preferuje niziny, ale istnieją doniesienia o spotkaniu go na wysokości 2300 m. Zajmuje różnorodne środowiska roślinne, zarówno lasy, tereny krzewiaste, jak i porośnięte niższą roślinnością. Rozmnaża się w różnorodnych zbiornikach wód stojących, w tym sztucznych. Żywi się drobnymi bezkręgowcami, głównie owadami (zwłaszcza chrząszcze) i pająkami. Menu zmienia się w zależności od miesiąca i roku. Zdarzają się w nim też jaja innych płazów.
W Europie Środkowej rozród zaczyna się w maju. Po ampleksusie samica składa żółtawe, otoczone galaretowatą osłonką jaja (skrzek), do 10 kłębów po 10–50 sztuk. Wylęgają się z nich żółtooliwkowe, pływające wolno kijanki, mierzące do 5 cm długości. Przeobrażają się po 90 dniach na przełomie lipca i sierpnia lub też dopiero w następnym roku. Zwierzę bywa hodowane w terrariach. W Europie Zachodniej jego liczebność obniża się, co ma związek ze zmianami w środowisku spowodowanymi działalnością ludzką. W związku z tym rzekotka figuruje w wielu czerwonych listach i księgach, IUCN przyznaje jej status LC. Prowadzi się działania zmierzające do ochrony gatunku, chronią go również liczne prawodawstwa.
Systematyka
[edytuj | edytuj kod]Rzekotka drzewna jest głównym członkiem Hyla arborea complex, grupy gatunków zamieszkujących Europę i Azję[2]. Używa się też terminu Hyla arborea group. Należy tu 16 gatunków[3], w tym wszystkie gatunki azjatyckie w liczbie 10. Europę, północ Afryki i Bliski Wschód zamieszkuje 5 gatunków[4]. Można wśród nich wymienić między innymi Hyla sarda, Hyla intermedia i rzekotkę śródziemnomorską[5].
Gatunki te zaliczają się do rodzaju Hyla, obejmującego jeszcze 3 inne grupy gatunków (cinerea, versicolor i eximia), co daje w sumie 31 gatunków zamieszkujących Holarktykę. Rodzaj należy z kolei do podrodziny Hylinae liczącej około 590 gatunków. Zalicza się ona do rodziny rzekotkowatych (Hylidae), jednej z największych rodzin płazów, obejmującej około 870 gatunków[3].
Pierwszy człon polskiej nazwy wziął się od rechotania samców. Drugi człon jej nazwy odwołuje się do zdolności wspinania się po drzewach[6].
Postulowano wyodrębnienie populacji zamieszkującej tereny od północnych stoków Alp do Sycylii z podgatunku nominatywnego H. arborea arborea do nowego gatunku Hyla italica, kierując się zróżnicowaniem loci genów kodujących białko[7], obecnie jednak takiego gatunku się nie wyróżnia[8], pojawiła się natomiast Hyla intermedia[9].
Do rodzaju włączano kiedyś Hyla arborea sarda, rzekotkę wyróżniającą się ziarnistą skórą zdobioną jasnymi i ciemnymi plamami, żyjącą na kilku wyspach Morza Śródziemnego[10]. Jednakże obecnie uważa się ją za oddzielny gatunek[11]. Podgatunek H. arborea kretenis bywa uważany za synonim H. arborea[3]. Podobnie Hyla intermedia bywała niekiedy utożsamiana z rzekotką drzewną. Pogląd ten wyznawała jeszcze Frost w 2004[4].
Ewolucja
[edytuj | edytuj kod]Kladogram z pacy Smith et al. z 2005[4], opierający się na analizie Bayesa dwóch genów mtDNA i dwóch jądrowych, uproszczony:
Stöck i współpracownicy zaproponowali w 2008 następujący kladogram powstały na bazie badań mtDNA[3] (uproszczono):
Drzewo z tej samej pracy, z wykorzystaniem genu RAG1[3], uproszczono:
Wynik badania zespołu Stöcka z 2011[12]
|
Wedle Smith i współpracowników (2005) oraz wcześniejszych prac Caroll (1988) czy Homana (1998) ostatni przodek europejskich rzekotkowatych, wśród których Smith et al. wyróżniają 5 gatunków, żył co najmniej 10 milionów lat temu, dokładniej w zakresie 10–23 miliony lat temu, co oznacza miocen dolny. Naukowcy przedstawili analizę Bayesa badań dwóch genów DNA mitochondrialnego (12S, ND1) oraz dwóch genów jądrowych (POMC, c-myc). Najmniej od rzekotki drzewnej różniła się Hyla savignyi (szacowany cały rozdział linii wynosi mniej niż 10 milionów lat temu), w następnej dopiero kolejności rzekotka śródziemnomorska (około 20 milionów lat temu). Jeszcze wcześniej oddzieliła się linia prowadząca do Hyla annectans i Hyla chinensis, było to mniej niż 25 milionów lat temu[4].
Badania genetyczne opublikowane przez Stöcka i współpracowników w 2008 wykazały stopień pokrewieństwa pomiędzy gatunkami. Z badań mitochondrialnego DNA wynika, że najbliżsi krewni rzekotki drzewnej zaliczają się do kladu tworzonego przez Hyla intermedia (stanowiąca grupę siostrzaną kladu złożonego z pozostałych wymienionych) Hyla sarda, Hyla orientalis, Hyla gumilevskii, Hyla molleri. Inny rezultat dało badanie z użyciem genu RAG1 (politomia wielu gatunków). Naukowcy sądzą, że rozdzielenie się rzekotki drzewnej, Hyla orientalis, Hyla molleri, Hyla intermedia i Hyla sarda nastąpiło pod koniec kryzysu messyńskiego, po zatopieniu licznych regionów, co spowodowało rozdzielenie populacji. Wydarzyło się to około 5,3 miliona lat temu[3]. W kolejnym badaniu z 2011 w oparciu o sekwencje DNA mitochondrialnego i jądrowego, zespół tego samego autora pisze o podziałach sprzed 5,4–7,1 miliona lat. Czas podziału na podstawie badań cytochromu b oszacował on na 7,1 miliona lat temu (wczesny messyn), podczas gdy badanie intronów fibrynogenu alfa wskazuje na 5,4 miliona lat (późny messyn)[12].
Dawniej upatrywano przyczyn rozdzielenia się rzekotek drzewnej i śródziemnomorskiej w zlodowaceniu[13]. Badania te wykazują istnienie kladu złożonego z rzekotek drzewnych zamieszkujących Grecję, w tym Kretę, i Chorwację. Autorzy wyjaśniają to starym polimorfizmem genetycznym sięgającym wstecz plejstocenu, gdy rzekotki ostały się na Bałkanach. Uważają też, że jedna z linii prezentująca jeden z wariantów mtDNA rozprzestrzeniła się później[3]. Dufresnesa i współpracownicy jako refugia wymieniają południowe Bałkany i wybrzeże Adriatyku, trzecia linia po ostatnim maksimum glacjalnym rozprzestrzeniła się na Kotlinie Panońskiej. Populacje zamieszkujące północną i zachodnią część Europy są młodsze[14].
Genetyka
[edytuj | edytuj kod]Chromosomy rzekotki, o czym świadczą porównania z plataną, są konserwatywne. Występuje ich 12 par. Dawniejsze chromosomy odpowiadające parom 4, 7 i 8 platany w linii rzekotek uległy podziałowi. Odwrotnie natomiast fragmenty 4A i 7A połączyły się u rzekotek w pojedynczy chromosom[15].
Częstość rekombinacji zależy od płci (cheterochiazmia) i od fragmentu chromosomu. O ile u samic tempo rekombinacji jest w miarę stałe, u samców ulegają jej zwłaszcza końcowe fragmenty chromosomów. Pomiędzy parami chromosomów w trakcie podziału mejotycznego najczęściej tworzą się zaledwie 2 chiazmy – po obu końcach chromosomów. Zmniejszona częstość rekombinacji u samców spełnia zasadę Haldane’a-Huxleya[15].
Płeć determinowana jest genetycznie. Hemizygotyczne są samce, co potwierdzono poprzez badania nieulegającego rekombinacji locus WHA 5-22A[5]. Chromosom płciowy przypomina chromosom 1 platany szponiastej. Brelsford et al w 2013 znaleźli 13 wspólnych markerów[16]. System determinacji płci u rzekotki drzewnej liczy sobie przynajmniej 5 milionów lat[15]. Występują chromosomy X i Y, bardzo podobne do siebie[12]. Świadczy to o tym, że w tym czasie musiały zachodzić rekombinacje, które zapobiegły degeneracji chromosomu Y[15], spowodowanej brakiem rekombinacji obserwowanym u ssaków[17]. Rzekotka drzewna odziedziczyła je po przodku wspólnym z Hyla intermedia. Badania zespołu Stöck dowodzą, że to właśnie zachodzące co jakiś czas rekombinacje, a nie epizody odwrócenia systemu determinacji płci utrzymały chromosom Y. W rezultacie chromosomy płci, które ewidentnie jawią się badaczom jako nowe (w momencie podziału linii rzekotki drzewnej, Hyla intermedia i Hyla molleri nie były one jeszcze zróżnicowane) noszą na sobie bardzo stare geny[12]. Za gen determinujący płeć uchodzi choćby Dmrt1[15]. Rekombinacja chromosomu Y zatrzymała się jeszcze przed powstaniem współczesnego gatunku. Wskazano kilka różnych niepodlegających rekombinacji haplotypów tego chromosomu[12]. Mimo licznych krzyżówek laboratoryjnych rekombinacji nie udawało się zaobserwować u samców. Zespołowi Dufresnesa udało się zaobserwować w ograniczonym zakresie i to głównie u płazów z południowych Bałkanów bądź wybrzeża Adriatyku. Populacje zamieszkujące refugium na Bałkanach cechują się częstszą rekombinacją chromosomów płciowych, niż rzekotki żyjące na północ i na zachód – w tych populacjach, młodszych od bałkańskich, nie występuje ona w ogóle. Populacja pannońskie wykazują w tym względzie cechy pośrednie[14].
Budowa
[edytuj | edytuj kod]Wymiary
[edytuj | edytuj kod]Rzekotka drzewna dorasta do 5 cm długości[18][6], choć nieraz podaje się 3–4[19], do 5,2[10] czy 4–6 cm[20]. W Portugalii średnia odległość pysk – kloaka wyniosła 37,7 mm, mieszcząc się w zakresie od 35 do 40 mm[21]. W Szwajcarii przystępujące do rozrodu osobniki mierzą 34,9 mm u samców oraz 36,4 mm u samic. Wedle badań greckich średnia odległość od pyska do kloaki wynosi 39,5 mm u samców (mieszcząc się w zakresie 32,2–45,8 mm) oraz 43,7 mm u samic (zakres 32,6–47,9 mm). Wyniki niemieckie, bazujące na pomiarach wykonywanych w okolicach Monachium, wskazują na większe rozmiary płazów, średnie wynoszą odpowiednio 43,2 oraz 44,5 mm. Korelacji długości ciała z szerokością geograficzną nie zauważa się[22].
Masa ciała wykazuje różnice w zależności od płci. Lżejsze samce ważą przeciętnie 8–9 g, cięższe od nich samice osiągają natomiast średnio 11 g, mogą jednak ważyć nawet 15 g[10]. W Portugalii masa przystępujących do godów zwierząt wyniosła średnio 4,41 g, wahając się od 3,6 do 5,6 g[21]. Czyni to rzekotkę niewielkim płazem[18], jednym z najmniejszych lądowych przedstawicieli tej gromady żyjących w Europie Zachodniej[20]. Rozmiarami przewyższa ją choćby jej krewna rzekotka śródziemnomorska[21]. Podczas trwającego dwa lata badania zawsze na przekroju paliczka w drugim roku znajdywano jeden spoczynkowy słój więcej, niż w poprzednim. Wskazuje to na roczny cykl wzrostu paliczków i potwierdza, że badanie kośćca stanowi najlepszą metodę oceny wieku płaza, podczas gdy poleganie na rozmiarach ciała nie jest wiarygodne. Dowiedziono w ten sposób, że rozmiary ciała korelują z wiekiem u osobników obu płci, jednak z wiekiem tempo wzrostu spada. Samce dwuletnie są mniejsze od liczących sobie przynajmniej trzy lata, trzyletnie zaś od co najmniej czteroletnich. Jednak te liczące 4, 5 lub 6 lat nie różnią się już znacząco. W przypadku samic już te trzyletnie nie wykazują znaczących statystycznie różnic ze starszymi. Z drugiej strony zaobserwowano, że jednoroczne samce z jednego roku mogą przewyższać wielkością dwuletnie samce z innego roku. Średni wiek i rozmiary samic są większe, niż u samców. Zależność pomiędzy wiekiem a rozmiarami ciała w przypadku rzekotki drzewnej przypomina te spotykane u innych bezogonowych[23].
Skóra i ubarwienie
[edytuj | edytuj kod]
Budowę ciała tego zwierzęcia określa się jako kształtną, wydłużoną. Skóra różni się w dotyku w zależności od regionu ciała. Podczas gdy na grzbiecie sprawia wrażenie gładkiej, delikatnej, lśniącej, na brzuchu i bokach ciała jest już chropowata[18]. Sprawia wrażenie błyszczącej, nie licząc osobników niedługo po opuszczeniu kryjówek zimowych[10]. Płaz wykazuje zmienność ubarwienia. Jego kolor zależy od pory roku, podłoża i wilgotności. Na grzbiecie przyjmuje zazwyczaj barwę zieloną, rzadziej spotyka się osobniki od ubarwionych jasnożółto do bardzo ciemnych[18]: brązowe, oliwkowozielone, ochrowe, czarniawe, a nawet niebieskie[10]. Zaobserwowano, że osobnik barwy intensywnie zielonej może w krótkim czasie stać się żółtawy, szary czy brązowawy[6]. Donosi się też o rzekotkach niemal czarnych czy niebieskich[19]. Po bokach ciała biegnie ciemna smuga rozpoczynająca się w okolicy nozdrzy, kończąca w biodrach[6], przebiegająca przez oko i błonę bębenkową wytwarzająca ponad udami ciemną, dużą zatokę[19] zwaną zatoką biodrową, dobrze widoczną w spoczynku[10]. Odgrywa ona rolę w doborze płciowym[24]. Stanowi ona cechę odróżniającą H. arborea od blisko spokrewnionego gatunku rzekotki śródziemnomorskiej. Brzuszna strona ciała przyjmuje kolor żółtawy[10], białawy czy białawoszary z zaznaczonym delikatnym groszkowaniem[19]. Ubarwienie ma charakter maskujący, siedząca na liściach czy gałązkach roślin rzekotka staje się prawie niewidoczna[6].
Wyróżniają się osobniki młode. W sierpniu i wrześniu, gdy usadawiają się wysoko na roślinności, barwi je opalizująca jasna zieleń, często współistniejąca ze złotawym połyskiem[10].
Rzekotka drzewna potrafi dostosować swe ubarwienie do koloru podłoża, zwłaszcza do jasności, w mniejszym stopniu innych parametrów jego barwy. Zdolnością tą i tak przewyższa swą krewną rzekotkę zieloną (choć w przeciwieństwie do niej nie osiąga barwy oliwkowożółtej)[25]. Najczęściej przyjmuje barwę zieloną, pozwalającą na ukrycie się wśród roślinności, jednakże nawet większość obserwowanych osobników może przyjmować inną barwę. Spotyka się np. osobniki czarne. Niekiedy w tym samym miejscu znaleźć można rzekotki drzewne kilku wariantów ubarwienia[26]. Zmiany ubarwienia warunkowane są strukturalnymi modyfikacjami chromatoforów. Płaz rozjaśnia swą szarą skórę poprzez agregację melanosomów. Podczas ciemnienia skóry odnotowano rozpraszanie się melanosomów melanoforów, otaczających irydofory, a częściowo także ksantofory. Te ostatnie również modyfikują swój kształt: z soczewkowatego na płytkowaty. Również one mogą migrować w głębsze warstwy skóry, a nawet ustawiać się poniżej irydoforów. Skóra przybiera wtedy barwę szarą. Zmiana koloru z zieleni na szarość nie odbywa się bezpośrednio, ale poprzez ciemną zieleń, oliwkową zieleń i w końcu ciemną szarość. W zależności od zmiany barwy irydofory zmieniają kształt z kubkowatego na stożkowaty czy cylindryczny dzięki mniej regularnemu rozłożeniu płytek, gdy staje się ona ciemniejsza, w skórze szarej przypominają zaś piłki z koncentrycznym, warstwowym rozkładem płytek[27]. Odnotowano, że zmiany irydoforów i ksantoforów przebiegają równolegle, melanoforów zaś niezależnie od nich[25]. Istnienie osobników niebieskich warunkuje nieobecność barwnika żółtego[10].
W porze godowej samiec demonstruje różnorodnie ubarwiony[24] nieparzysty worek rezonansowy. Kiedy nie jest rozdęty, widać na prawie całym podgardlu żółtobrązowy obszar, nieobecny u samicy[10]. Narząd ten zawdzięcza swe kolory karotenoidom. Barwniki te stanowią dla organizmu drogocenne substancje, dostarczane wraz z pożywieniem. Biorą udział choćby w obronie przed patogenami. Możliwość użycia ich jako sygnału płciowego stanowi więc oznakę dobrej kondycji samca[24].
U H. arborea arborea obserwowano skórne gruczoły surowicze produkujące jad merokrynowo, poprzez egzocytozę, podczas gdy w przypadku tego typu płazich gruczołach obserwowano wydzielanie holokrynowe. Pojawiają się one u kijanki na etapie kończyn tylnych, później drobne krople jadu skupiają się w większe, różnorodne. U osobników młodocianych pojedyncze porcje jadu trafiają do wąskiego światła gruczołu leżącego pod wstawkami, u dorosłych znaleziono tylko duże struktury złożone z mniejszych ziaren, tworzące powtarzający się wzór. Jad wyprodukowany został z udziałem siateczki śródplazmatycznej szorstkiej i aparatu Golgiego[28].
Od rzekotki śródziemnomorskiej rzekotkę drzewną odróżnia się po ciemnym pasie biegnącym aż do bioder, u H. meridionalis kończącym się u nasady ramienia (u osobników młodych mogą przechodzić na boki tułowia). Dodatkowo rzekotki śródziemnomorskie są nieco większe i często cechują się jaśniejszą zielenią grzbietu. Samce mają też podłużny fałd na worku rezonansowym, niespotykany u rzekotki drzewnej, na skutek którego rechot staje się głębszy i wolniejszy. Zapobiega to też krzyżowaniu się obu gatunków[29].
Anatomia
[edytuj | edytuj kod]
Hyla arborea ma duże, wyłupiaste oczy o złotawych tęczówkach[18]. Bezogonowe, posiadając dwa rodzaje pręcików, dysponują wzrokiem silnie wyczulonym na niewielką ilość światła. Wykorzystują go głównie podczas polowania[24].
Płuca tworzą połączone w siatkowatą strukturę fałdy od pierwszego do trzeciego rzędu. Wyściela je w większości pojedynczy rodzaj pneumocytów, a z wyjątkiem trzeciego także przez rozmieszczony w postaci nieregularnych kępek nabłonek urzęsiony. W cytoplazmie pneumocytów stwierdza się trzy rodzaje ciałek: lamelarne, gęste (z których tworzą się w przyszłości lamelarne) i wielopęcherzykowate (włączone w lamelarne). Nie występują w nim komórki kubkowe, w przeciwieństwie do kopulastych ciałek neuroepitelialnych rozlokowanych na jego obrzeżach. Pneumocyty wydzielają ciałka blaszkowate do przestrzeni wypełnionej przez powietrze, tubularne struktury mielinowe stanowią jednak rzadkość. Bariera pomiędzy krwią i powietrzem ma 0,6 μm grubości, tworzą ją nabłonek płuc, śródbłonek naczynia krwionośnego i przestrzeń śródmiąższowa[30].
Długie[19], niewiele dłuższe od ciała, sprawiające wrażenie delikatnych[10] kończyny dolne kończą się długimi palcami zaopatrzonymi buławkowatego kształtu przylgami[18], podobnie jak łapy przednie[19]. Mają one za zadanie umożliwić zwierzęciu przebywanie na gładkich liściach[18]. Za skoki odpowiada mięsień brzuchaty łydki[31].
Występuje dymorfizm płciowy. Podgardle samca jest ciemniejsze niż u samicy. Dysponuje on też wspomnianym już workiem rezonansowym dużej wielkości, umiejscowionym na podgardlu. Wydawany przez niego dźwięk określa się jako doniosły, wysoki, ciągły turkot. Wydaje się on donioślejszy niż odgłosy innych występujących w Polsce bezogonowych[18]. Prócz niego w okresie godowym osobnik płci męskiej rozwija również modzele na kciukach[10].
Tryb życia
[edytuj | edytuj kod]
Na przełomie marca i kwietnia[10] lub też w kwietniu Hyla arborea wybudza się z letargu zimowego, by na początku maja przystąpić do rozrodu. W środowisku wodnym przebywa krótko. Wiedzie lądowy tryb życia[18]. Spotyka się ją od maja do września[6]. Zimę zwierzę to spędza zagrzebane w ziemi w sąsiedztwie zbiornika wodnego czy w wilgotnym zagłębieniu. Rzadziej zimuje w suchej glebie. Sen zimowy rozpoczyna z końcem września lub początkiem października[10].
Aktywność przypada na zmierzch i na noc[19]. Z drugiej strony podnosi się, że potrzebuje ona dużo słońca, co ma związek z tropikalnym pochodzeniem rzekotkowatych[10].
Rzekotka drzewna większą część swego życia spędza na roślinach. Wspina się zręcznie dzięki takim adaptacjom jak przylgi czepne na palcach czy płaski kształt ciała. Przylgi sprawiają, że lądująca Hyla potrafi utrzymać się w danym miejscu docelowym, jeśli przyczepi się doń tylko jedną przylgą. Dzięki spłaszczeniu ciała zaś bezogonowy potrafi przylgnąć brzuszną stroną ciała do powierzchni, na którą się wspina. W efekcie bardzo sprawnie idzie jej wspinaczka. Potrafi nawet poruszać się po pionowych powierzchniach[10]. Siedlisko rzekotki utrudnia badanie jej. W związku z tym specjaliści używają HDF (Harmonic Direction Finder), urządzenia służącego do lokalizacji noszącego je obiektu za pomocą mikrofali[32].
Budowa kończyn dolnych umożliwia zwierzęciu skoki[10].
Zamierając w bezruchu, przyjmuje okrągły kształt, z kończynami przyciśniętymi do tułowia. Zapewnia sobie kamuflaż, dostosowując barwę skóry do otoczenia[10].
Cykl życiowy
[edytuj | edytuj kod]
Wydłużony[33][34] okres rozrodczy w Europie Środkowej zaczyna się na początku maja[18] (spotyka się też z informacjami, że jest to połowa kwietnia[19]), na przykład w południowych Niemczech chodzi o koniec kwietnia lub początek maja, koniec rozrodu następuje zaś na początku lipca[34], w Rumunii zaczyna się on w marcu, trwając do maja[33]. Rozród następuje więc później, niż u większości bezogonowych. W jednym z badań samice obserwowano w miejscu godów od 10 maja do 22–23 czerwca. Poszczególne osobniki wybierają z reguły z roku na rok ten sam zbiornik, zwykle wysychający w porze letniej w terminie zależnym od ilości opadów[23]. Migracje zdarzają się tylko, jeśli nowy staw oddalony jest od poprzedniego na mniej niż 320 m. W miejscu rozrodu samce przewyższają liczebnie samice, w 1990 i 1999 obliczono stosunek ich liczebności odpowiednio na 1,52:1 i 2,15:1[23].
Gody
[edytuj | edytuj kod]Jedynie podczas okresu godowego płaz ten nie spędza czasu na roślinach. Za dnia płazy te przebywają na brzegu, zwłaszcza w czasie sprzyjającej pogody, wieczór zaś i noc spędzają w wodzie[10].
Samce rechoczą donośnie w pobliżu zbiorników wodnych w maju i w czerwcu, w pierwszej połowie nocy[35], chociaż istnieją informacje o rechocie trwającym do późnej nocy. Istnieją też jesienne nawoływania rzekotki na przełomie sierpnia i września[10].
Gdy zapadnie zmierzch, samce rozpoczynają swój chóralny rechot[10]. Usadawiają się wtedy zwykle nieco nad poziomem wody[24] lub na jej powierzchni. Częściej wybierają taflę wody, niż okoliczną roślinność[21]. Ustalają rewiry o średnicy 3 m – tyle dzieli sąsiadujące bezogonowe. Gdy na obszar ten wkroczy rywal, jest przeganiany[10] Rechocząc, samce prezentują boczne części swych worków rezonansowych[24]. Ich odgłosy opisuje się jako „repp-repp-repp”[6] albo „ep-ep-ep...”. Rechot wielu osobników zlewa się z sobą, a przez to wzmacnia, przywabiając samice do zbiornika wodnego[10]. Chór liczy sobie przeciętnie 11,1 płaza z odchyleniem standardowym 5,3[9]. Seria odgłosów liczy sobie ich od 12 do 30, średnio 20,99 lub 19,94 u samców przystępujących do rozrodu i 22,14 lub 19,95 u nieprzystępujących. Pojedynczy odgłos trwa średnio 63 lub 65,38 u tych pierwszych i 64,01 lub 65,67 u tych drugich[34], ogólnie średnio 65,0 ms, a przerwa 138,1 ms. Ma on wedle Castellano częstotliwość 5,1 Hz[9]. Friedl naliczył w ciągu minuty średnio 162,35 lub 149,91 odgłosu (zależnie od roku, zakresy 106,07–196,72 i 89,07–217,57) u samców spółkujących i 160,18 lub 146,33 (94,49–209,92 lub 103,83–196,66) u niespółkujących[34]. Przeciętnie ilość pulsów w jednym odgłosie wynosi 8,2[9], mieszcząc się w zakresie 6–11. U samców rozradzających się średnia wyniosła 7,83 lub 7,84 (zakres 7,02–8,59 lub 7,50–8,35), u niewybranych przez samicę 7,97 lub 7,85 (7,63–8,49 lub 7,11–8,53), pojedynczy puls trwał odpowiednio 8,10 lub 8,51 ms (7,47–8,33 lub 7,83–9,39 ms) oraz 8,09 ms lub 8,55 (7,46–8,64 lub 7,88–10,39 ms)[34], z częstotliwością 128 Hz. Częstotliwość podstawowa wynosi średnio 953,1 Hz[9] (zakres 900–1200 Hz[34]), a dominująca 2121,5 Hz[9], dokładniej 2068,1 lub 2165,6 Hz (1965,3–2190,5 lub 2027,2–2429,2 Hz) u samców, którym udał się przystąpić do kopulacji, i 2153,3 lub 2146,3 Hz (1959,3–2325,9 lub 1976,4–2422,7 Hz) u pozostałych[34]. Średnio samce rzekotki drzewnej osiągały 88,85 dB. Zakres rozciągał się od 77,80 do 94,48 dB. W porównaniu z większą, co oznacza również obecność większego gardła, rzekotką śródziemnomorską (91,64 dB, zakres 81,47–97,67 dB) samce rzekotki drzewnej rechoczą mniej intensywnie[21].
Zarówno właściwości spektralne rechotu, jak i związane z czasem modyfikuje temperatura. Wielkość ciała wpływa natomiast głównie na właściwości spektralne wydawanych dźwięków, odpowiada za 11% zmienności w obrębie populacji i aż 73% różnic międzygatunkowych w obrębie tego samego kladu[9]. Być może niektóre wzorce rechotu podlegają dziedziczeniu. Jedno z badań pokazało, że samce o przeciętnej liczbie pulsów mają większą szansę na przystąpienie do rozrodu, niż osobniki o zbyt dużej lub zbyt małej ich ilości (dobór stabilizujący), wydaje się jednak, że rechot nie stanowi istotnego czynnika w doborze naturalnym rzekotek drzewnych (większość różnic pomiędzy obserwowanymi cechami rechotu nie wykazuje istotności statystycznej). Nie zaobserwowano też istotnych różnic między kumkaniem samców, które przeżyły następny rok, i takimi, którym się to nie udało[34]. Wydając z siebie 8000 dźwięków na minutę, samiec zużywa na ten cel średnio 1,076 ml tlenu/h, choć zaobserwowano trzykrotne różnice przy tej samej częstości rechotania. 69% tej energii pochodzi z utleniania węglowodanów, których znaczenie wzrasta wraz z większą częstością wydawanych dźwięków. Część energii dostarczają lipidy[35]. Udało się eksperymentalnie pobudzić samca do rechotania przez drażnienie prądem elektrycznym jądra przedwzrokowego przedniego. Jednakże amplituda dźwięków wzrastała szybciej, niż u naturalnie rechoczących osobników. Pobudzenie tego jądra spowodowało wydawanie dźwięków również u samic. Stan gotowości do wydawania dźwięków osiągnięto zaś za pomocą drażnienia prócz uprzednio wymienionego także jąder przedwzrokowego tylnego, wielkokomórkowego i podwzgórza[36]. Przeciętnie samiec kumka w chórze przez 7,5 nocy. Zależy to od minimalnej temperatury dziennej i w czasie rozpoczęcia śpiewu, a także opadów. Zmienne te odpowiadają za 37,8% rozkładu uczestnictwa samców w chórze[37].
Późniejszymi porami roku samce rechoczą również na lądzie[10]. Ponadto nie kumka on cały czas, ale część czasu poświęca żerowaniu[38].
To samica dokonuje wyboru[10]. Szukając partnera, kieruje się wydawanym przez niego głosem[19]. Preferuje też samce o kolorowym worku rezonansowym i stanowiącej przedłużenie jego wzoru dużej czarnej wstędze na boku ciała, dobrze odróżniającej się od grzbietu i brzucha, schowanej częściowo pod kończynami za dnia, gdyż rzucałaby się w oczy drapieżnikom. Samica wybiera osobniki o najciemniejszych barwach (danych tych nie tłumaczy fototaksja ujemna, gdyż nocne bezogonowe wykazują raczej fototaksję dodatnią). Poleganie na kilku zmysłach, a nie jednym, usprawnia znalezienie odpowiedniego samca, pozwala też na lepsze odróżnienie od siebie osobników różnych gatunków, zwłaszcza wśród składającego się z wielu osobników różnych gatunków chóru[24].
Głos i ruchliwość wskazują na dobrą kondycję i atrakcyjność samca[31]. W przeciwieństwie do samic inwestujących energię w składane jaja samce wielu gatunków przeznaczają ją głównie na ekstrawaganckie pokazy. Taki sposób rozrodu nazywa się lek[38]. Mięśnie związane z wydawaniem dźwięków znajdują się pod większym wpływem testosteronu[31]. Wysoki poziom tego steroidu wiąże się z bardziej atrakcyjnymi dźwiękami. Co więcej, wedle badań zespołu Julli Desprat z 2017 podwyższony sztucznie poziom testosteronu zmniejsza latencję orientacji w przypadku zdobyczy i przyśpiesza atakowanie ofiary (nie wpływa natomiast na odsetek ataków na zdobycz uwieńczonych sukcesem) – samce, którym podano testosteron, uważniej wypatrywały zdobyczy, a po dostrzeżeniu jej ich układ nerwowy szybciej przetwarzał informację, umożliwiając szybszy atak[38] (receptory androgenowe znaleziono już wcześniej w mózgu płazów[39]). Tracąc mniej czasu na zdobywaniu pokarmu, samiec może dłużej nawoływać samice[38].
Wedle Friedla w dwóch kolejnych latach 1990 i 1991 42,1% i 41,1% z oznaczonych przez niego 38 i 56 samców przystąpiło do spółkowania[34].
Zachodzi ampleksus, podczas którego samiec przytrzymuje partnerkę uchwytem pachwinowym[19] w okolicy bioder[10]. Pozycje typowe dla rozrodu osobnik każdej płci przyjmuje także po pobudzeniu elektrycznym jądra przedniego przedwzrokowego[36]. Wczesne złożenie jaj oznacza też wcześniejsze przeobrażenie i większe rozmiary młodych płazów. Późne przystąpienie do składania skrzeku w połączeniu z szybszym wyschnięciem zbiornika wodnego oznacza zwiększoną śmiertelność larw[23].
Rozwój młodych
[edytuj | edytuj kod]Samica składa żółtawe, otoczone galaretowatą osłonką jaja (skrzek) w postaci kłębów. Wedle starszych źródeł jeden zawiera od 800 do 1000[18] lub około 1000 jaj[10], wedle nowszych jedynie około 25[6] lub 10–50[19]. Pojedynczy pakiet osiąga rozmiary orzecha włoskiego, a samica tworzy ich do 10, co oznacza niewielką płodność gatunku[6].


Z jaj wylęgają się larwy zwane kijankami. Osiągają one długość do 5 cm (tyle samo osiąga dorosły płaz). Zabarwione są żółto-oliwkowo[18], zielono[40] lub ciemno-szaro ze złotymi cętkami. Wyróżnia je wysoka, zaczynająca się już na głowie, błona płetwowa[10]. Fałd płetwowy wysokością dwukrotnie przewyższa sam tułów[40]. Są aktywne, pływają wolno, co naraża je, podobnie jak kijanki ropuchy szarej, na zagrożenie ze strony larw ważek. Lepiej jednak od B. bufo sobie z nim radzą, preferując inne siedliska i będąc bardziej nieuchwytne[41]. Żywią się roślinami wodnymi i glonami. W Izraelu nie stwierdzono preferencji co do głębokości, na której żyją, ani też różnic w szybkości wzrostu kijanek z dna zbiornika i żyjących przy powierzchni[42]. Badania prowadzone w Narwiańskim Parku Narodowym i Suwalskim Parku Krajobrazowym wykazały, że często współwystępują i dobrze znoszą obecność larw kumaka nizinnego, w mniejszym zaś stopniu zależność ta zachodzi dla traszki zwyczajnej, grzebieniastej i ropuchy paskówki[43]. Okazuje się, że ich rozwój może zależeć od obecności drapieżników. We Francji opisano wyższe ogony u kijanek eksponowanych na działanie drapieżników w porównaniu z larwami, które ich nie zaznały. Drapieżnictwo spowalnia również tempo rozwoju larw. Masa kijanek nie zależy od zagrażającego drapieżnictwa w łagodnych warunkach, w przeciwieństwie do trudnych[44]. Przeobrażają się po upływie 90 dni, jednak mogą też zimować i podlegać metamorfozie dopiero w następnym sezonie[18]. Metamorfoza przypada zwykle na koniec lipca i sierpień[19]. Młode rzekotki drzewne osiągają 16 mm długości[10].
Osobniki obu płci osiągają dojrzałość w drugim roku życia. Wtedy też, po dwukrotnym w ciągu swego życia przezimowaniu, przystępują pierwszy raz do rozrodu. Zaobserwowano jednak rozmnażającego się rocznego samca. Nie odnotowano natomiast zwierząt dojrzewających później, od trzeciego roku życia[23]. Z innej strony badania greckie wykazały późniejsze o rok przystępowanie do rozrodu samic względem Niemiec i Szwajcarii. Nie towarzyszyła im różnica w długości ciała. Wnioski te opierają się jednak na niewielkiej grupie samic. Jednakże podobne wyniki zaobserwowano u żab z rodzaju Rana, jak Rana perezi, Rana sylvatica czy żaba trawna[22].
Wedle badań greckich najliczniejsze grupy wiekowe samców obejmują osobniki trzyletnie i czteroletnie. Przeciętny wiek samca wynosił w nich 3,74 roku, odnotowano osobniki dwu- i sześcioletnie, w przypadku samic 4,7 roku, badane samice miały od 3 do 6 lat[22].
Nie stwierdza się różnicy w przeżywalności dorosłych samic i samców. W jednym z badań uzyskano co prawda różne współczynniki przeżywalności (odpowiednio 20% i 37%), różnica ta nie wykazuje jednak istotności statystycznej. Współczynniki te zależą od zmieniających się warunków środowiska i nie są takie same w kolejnych latach. Tester, badając je przez 4 lata, otrzymał dla samców przeżywalność od 15% do 44%, przy czym najmniejsza wartość wiązała się z surową zimą. Najstarsze zbadane osobniki liczą sobie sześć lat[23], choć mówi się o rzekotkach dożywających nawet 15 lat[19]. Choć średni wiek samicy jest większy, niż samca, maksymalna długość życia nie wykazuje różnic ze względu na płeć. Za najważniejszy czynnik wpływający na strukturę wiekową populacji uchodzą opady deszczu, toteż zmienia się ona znacznie w kolejnych latach. W jednym z badań wykazano, że osobniki dwuletnie stanowiły w tej samej populacji w 1990 9,7%, natomiast rok później już 69,5%. Uważa się, że za takie duże różnice wśród bezogonowych odpowiada zmienna przeżywalność w okresie larwalnym[23].
Rozmieszczenie geograficzne
[edytuj | edytuj kod]Zwierzę cechuje się szerokim zasięgiem występowania[2], jednym z najszerszych wśród gatunków Palearktyki[45]. Płaza spotyka się w Europie Środkowej i Południowej, w północno-zachodniej Afryce (IUCN nie podaje jej obecności na tym kontynencie[2]) i w Azji Mniejszej. Północna granica jego zasięgu przebiega na południu Szwecji[18] oraz w południowej i wschodniej Danii. Na zachodzie rozproszone populacje żyją na Półwyspie Iberyjskim. Dalej bezogonowy bytuje od Francji do zachodniej Federacji Rosyjskiej[2]. Na wschodzie sięga on Krymu i Kaukazu[18], niektóre źródła wymieniają tu też Ural[19], inne jej tam nie umieszczają. Na południu obejmuje swym zasięgiem występowania Bałkany i Turcję, nie licząc jej wschodniej i południowo-wschodniej części. IUCN dostrzega jednak konieczność dalszych badań rozmieszczenia płaza w południowej Turcji[2].
Płaza introdukowano w Wielkiej Brytanii, w New Forest[2]. Niegdyś, po ustąpieniu ostatniego zlodowacenia, kanał La Manche uniemożliwił mu skolonizowanie wysp[10]. Wydaje się jednak, że wyginął w tym kraju[2]. Natomiast egzystuje na Łotwie, również na skutek reintrodukcji[2].
Zasięg występowania rzekotki drzewnej obejmuje następujące państwa: Albania, Armenia, Austria, Azerbejdżan, Białoruś, Belgia, Bośnia i Hercegowina, Bułgaria, Chorwacja, Czarnogóra, Czechy, Dania, Rosja, Francja, Grecja, Gruzja, Hiszpania, Holandia, Liechtenstein, Litwa, Luksemburg, Łotwa (reintrodukowano), Macedonia, Mołdawia, Niemcy, Polska, Portugalia, Rumunia, Serbia, Słowacja, Słowenia, Szwajcaria (na początku XX wieku jednorodnie rozmieszczona w całym kraju, wiek później kilka nie kontaktujących się ze sobą metapopulacji[20]), Szwecja, Turcja, Ukraina, Węgry, Włochy[2]. Starsze publikacje znajdują rzekotkę także w Izraelu[42].
Obecność płaza w Iranie jest niepewna[2]. Skamieniałości tego gatunku (prawa kość biodrowa) znaleziono w Libanie[46].
W Polsce rzekotka występuje pospolicie w całym kraju[18].
W latach 1987–1992 podjęto próbę reintrodukcji zwierzęcia na Łotwę, do Parku Narodowego Gaua. Użyto osobników z Białorusi i trzymanych w niewoli w ogrodzie zoologicznym w Rydze[2].
Gatunek ten uznawano niegdyś za jedynego członka rodziny rzekotkowatych występującego w Europie[18]. Jednakże wiadomo obecnie, że na terenie Francji żyją prócz niej również rzekotka śródziemnomorska i Hyla sarda[47], tę pierwszą spotyka się też w Hiszpanii[48], w tym na obszarach niezamieszkanych przez rzekotkę drzewną[10]. Obecnie w regionie europejskim wraz z Bliskim Wschodem i Afryką Północną notuje się 5 gatunków[4].
Jest to zwierzę nizinne[2]. Choć wedle niektórych dociera w górach tylko do wysokości 1500 m[19], w Europie odnotowano jego obecność na maksymalnej wysokości 2300 m nad poziomem morza w Bułgarii, ale informacja ta wedle IUCN wymaga jeszcze potwierdzenia[2]. W polskich górach spotyka się ją rzadko, płaz sięga do piętra regla dolnego[18].
Ekologia
[edytuj | edytuj kod]Siedlisko
[edytuj | edytuj kod]Obszar występowania gatunku pokrywa się dość dokładnie z europejskim biomem lasów liściastych[10].
Rzekotka drzewna zasiedla drzewa, krzewy, rzadziej rośliny łąkowe o szerokich liściach[18], a także roślinność zielną[20] i niską roślinność przybrzeżną[2]. Wspina się zręcznie po drzewach i innych roślinach, robiąc użytek z przylg na palcach. Potrafi wspinać się nawet po gładkiej, pionowej powierzchni. Przebywa na liściach i gałązkach, maskując się dzięki swemu ubarwieniu[6]. Dochodzi w ten sposób do wysokości 10 m[19].
Rzekotka drzewna preferuje doliny rzeczne porośnięte lasem: łęgiem, niskim grądem czy lasem mieszanym. Lubi obszary obfitujące w kałuże, stawy, trzcinowiska, oczka wodne[10]. Jej siedliska stanowią widne lasy liściaste i mieszane[2], skraje lasów[6], zwłaszcza nasłonecznione[49], busz i tereny porośnięte krzewami[2], zarośla[6], łąki[2], zwłaszcza wilgotne i zadrzewione[6], pastwiska[19], brzegi jezior, ale także sady, parki, ogrody, winnice[2], żywopłoty, brzegi pól z dobrze rozwiniętą niską roślinnością, zwłaszcza porosłe jeżynami[49]. Spotykano ją nawet w dużych miastach. Unika natomiast ciemnych i gęstych lasów[2]. W Polsce występuje pospolicie głównie na terenach zasobnych w drzewa liściaste i gęste krzewy[18]. Potrafi przetrwać okresy suche, spotyka się ją więc także na terenach suchych[2]. Wedle innych źródeł nie oddala się ona jednak od zbiornika wodnego na odległość większą, niż kilkaset m[6]. Potrafi rozprzestrzeniać się z prędkością do 12,6 km rocznie[50] (wedle innych danych 10–12 km), rzadko jednak przebywa więcej niż 4 km. Prawdopodobieństwo zajęcia nowych obszarów zależy od ilości stawów w okolicy. Jednakże rzekotki wybierają zbiorniki już zasiedlone przez przedstawicieli swego gatunku, nawet jeśli leżą dalej od niezamieszkałych[49].
Claire Vos i Anton Stumpel w 1996 wykazali, że prawdopodobieństwo zajęcia przez rzekotkę stawu wiąże się z trzema czynnikami: obecnością innych stawów w odległości 750 m, obecnością krzaków oraz obecnością wysokiej roślinności zielnej[51], choć w 2005 takich związków nie wykrył Buskirk[52]. Poszczególne osobniki przywiązane są do „własnego” zbiornika[53].
Rozmnażanie ma miejsce w zbiornikach wód stojących, jak jeziora, stawy, bagna, także w sztucznych, a nawet w rowach i kałużach[2]. Może to być też staw, starorzecze, zatoka, jeśli jest spokojna, rozlewisko w dolinie rzecznej, dół po wydobyciu żwiru, oczko wodne. Zbiornik zarasta zwykle roślinność wodna. Ważna jest czystość wody oraz brak ryb i traszek[10]. Buskirk nie znalazł ani jednego stawu, w którym H. arborea koegzystowała by z rybami[52]. Rzekotki przystępują jednak do rozrodu w zbiornikach zamieszkanych przez żaby wodne, jeziorkowe i trawne, traszki grzebieniaste, zwyczajne i górskie[34]. W Skanii pojawiają się jednak informacje o zagrożeniu ze strony żaby wodnej[54]. Dla tego płaza najodpowiedniejsze wydają się zbiorniki o powierzchni od 1000 do 2000 m²[49]. Unika on wód kwaśnych[55]. Badania wykonane w Szwajcarii przez Pelleta i współpracowników (2003) wykazały następujące negatywne czynniki wpływające na zasiedlenie stawu przez rechoczące samce: urbanizacja przyległych terenów, niski opór elektryczny wody, nieznaczny czas nasłonecznienia wody. Chodzi tutaj o ogrzewanie wody przez promienie słoneczne, co oznacza wyższą temperaturę rozwoju larw, a więc i szybsze ich dojrzewanie, co przekłada się na większy sukces rozrodczy. Wysoka zdolność wody do przewodzenia wynikała w tym przypadku z jonów chlorkowych. Na podłożach wapiennych wynika z kationów wapnia i anionów wodorowęglanowych i węglanowych, wśród nawożonych pól z azotanów. Zaproponowano zdolność wody do przewodzenia prądu jako miarę eutrofizacji zbiornika, związanej z rozrostem glonów powodującym nad ranem powstanie warunków beztlenowych, niekorzystnych dla rozwoju kijanek. Rolę czynnika pozytywnego odgrywa w tym badaniu odległość dróg[56].
Wysokość nad poziomem morza, którą osiąga rzekotka, różni się na północnej i na południowej stronie Alp. Na północy dochodzi do 600 m, na południu zaś do 800 m[10].
Pożywienie
[edytuj | edytuj kod]
Płaz żywi się głównie owadami, na które sprawnie poluje[18]. Jego strategia polega na usadowieniu się na gałęzi czy w zaroślach i nieruchomym oczekiwaniu na pojawienie się zdobyczy, aż ta wpadnie w zasadzkę. Wtedy rzekotka może rzucić się na ofiarę. Atak taki wymaga sprawnej koordynacji bodźców dopływających z wpatrzonych w zdobycz oczu, obliczenia trajektorii precyzyjnego skoku i wysunięcia języka, by pochwycić nim ofiarę. Liczy się w nim szybkość, zwłaszcza w gęstej roślinności, wśród której ofiara za chwilę może przestać być w zasięgu drapieżnika[38]. Badania żołądków 585 dorosłych osobników z Rumunii pozwoliły dokładniej przyjrzeć się zdobyczom rzekotki. Większość z nich stanowiły dorosłe pająki i chrząszcze. Spośród tych ostatnich zidentyfikowano przedstawicieli 11 rodzin, z których największy udział miały biegaczowate, kusakowate, sprężykowate i stonkowate. Larwy chrząszczy znajdywano najczęściej w marcu (niecałe 22%) i na początku maja (24,4%). Imagines tego rzędu w marcu natrafiono w 53,7% bezogonowych, w kwietniu już w 60,1%, w maju na początku w niecałych 47,2%, później w prawie 42%, najczęściej jednak w czerwcu: w niecałych 72%. W sierpniu było to 12,5%, we wrześniu 40%. Pająki na początku maja są zjadane przez ponad ¾ osobników i w każdym miesiącu od marca aż do sierpnia znajdywano je w ponad połowie żołądków, we wrześniu jedynie w 0,2. Równonogów nie znaleziono w drugiej połowie maja i w czerwcu. Pluskwiaki różnoskrzydłe najczęściej pojawiały się we wczesnym maju (20,5%), by w następnym miesiącu w ogóle nie zostać znalezione. Pluskwiaki równoskrzydłe do maja stanowiły rzadkość, w pierwszej połowie tego miesiąca pojawiały się już w ponad 16% żołądków i do końca badania (wrzesień) nie spadały poniżej połowy przebadanych płazów. Larwy motyli w kwietniu i na początku następnego miesiąca dostrzeżono w ponad 40% (odpowiednio 45,5% i 43,3%). Larwy chruścików ukazały się jedynie w czerwcu, w drugiej połowie miesiąca w większej ilości (35,1%), i we wrześniu, tym razem obecne u prawie ⅔ płazów (65%). Imago krótkorogich były obecne od 2,4% przewodów pokarmowych w marcu do 30% we wrześniu, prawie 22,5% osiągając w kwietniu. Dojrzałe długorogie od kwietnia do sierpnia znajdywano w granicach 20–30% płazów. W marcu nie wymieniono ich w ogóle, we wrześniu osiągnęły wartość 15%. Błonkoskrzydłe były najchętniej spożywane w czerwcu (35,5% osobników). Nieznaczny odsetek stanowiły: ślimaki, zaleszczotki, roztocze, wije, skoczogonki, ważki, prostoskrzydłe, skorki, wielbłądki, sieciarki, wojsiłki, larwy muchówek. Zwraca uwagę prawie wyłączna obecność bezkręgowców lądowych, organizmy wodne znaleziono jedynie w marcu. Zaliczają się doń ślimaki, równonogi, larwy długorogich. W żołądkach znaleziono również szczątki roślin (najczęstsze we wrześniu – 35%, podczas gdy w czerwcu tylko 9,7%), kawałki złuszczonej skóry (tylko u zwierząt bytujących w środowisku wodnym), a także jaja płazów nie należących do rodzaju Hyla. Dokładniej zostały one złożone przez żabę moczarową i doszukano się ich u 4,9% osobników jedynie na początku okresu rozrodczego. Wtedy też odnotowano najwięcej płazów z pustym żołądkiem (w marcu – 14,6%, podczas gdy pod koniec czasu godów – w końcu maja – było to 2,3%, a po okresie reprodukcji – w czerwcu – 3%), co może być efektem godów lub skromnej dostępności pokarmu. Ich ilość ocenia się jednak jako niewielką. W związku z wydłużonym okresem rozrodczym płazy w jego trakcie nie zaprzestają zdobywania pożywienia. Rzekotki najmniej zróżnicowanym pokarmem żywiły się w sierpniu. Ich dieta z tego miesiąca najbardziej przypomina czerwcową, menu tych płazów z marca zaś jest najbliższe majowemu, a dopiero później kwietniowemu. Najbardziej od wszystkich innych różni się to wrześniowe. Poza tym w kolejnych sezonach obserwuje się znaczne różnice w diecie[33].
Bezogonowy musi zgromadzić zapasy energii pozwalające mu przetrwać zimę, ale także przystąpić po niej do rozrodu[33]. Sen zimowy rozpoczyna w czasie spadania wykorzystywanych przez niego jako schronienie liści z drzew. Rzadko spędza zimę na lądzie, częściej zagrzebuje się wtedy w szlamie na dnie zbiorników wodnych. Wiele osobników razem spędza zimę[18].
Interakcje międzygatunkowe
[edytuj | edytuj kod]Zwierzę oprócz maskującego ubarwienia nie posiada żadnej ochrony przed drapieżnikami[18].
Badania przeprowadzone w Turcji ujawniły pasożytowanie na rzekotkach drzewnych następujących robaków[57]:
- Acanthocephalus ranae (Schrank, 1788)
- Cosmocerca commutata (Diesing, 1861)
- Encyclometra colubrimurorum (Rudolphi, 1819)
- Pleurogenoides medians (Olsson, 1876)
- Polystoma skrjabini Buchvarov, 1984
- Proteocephalus sp. Weinland, 1858 (pleurocerkoid)
Zwierzę występuje sympatrycznie z innym gatunkiem – rzekotką śródziemnomorską. Odnotowano obecność bezpłodnych hybryd[2].
W niewoli
[edytuj | edytuj kod]W przeszłości uważano rzekotkę drzewną za pomocną w tworzeniu prognoz pogody. Trzymano ją z tego względu w specjalnych, wysokich terrariach[18]. Cały czas hoduje się ją jako zwierzę domowe[2].
W przeszłości przyznawano rzekotce drzewnej umiejętność przepowiadania pogody. Zaobserwowano bowiem płazy zajmujące miejsca wysoko na roślinach podczas ładnej, słonecznej pogody i spędzające czas nisko w czasie pogody ludziom mniej sprzyjającej: deszczowej czy pochmurnej. Za przyczynę tego zjawiska uchodzi zachowanie się owadów zależne od chwilowych warunków pogodowych. Jednakże niegdyś umieszczano rzekotkę w słoju, w którym znajdowała się drabinka, i od pozycji zwierzęcia na tejże próbowano przewidywać pogodę[10].
Zagrożenie i ochrona
[edytuj | edytuj kod]Występowała pospolicie[18], jednak obecnie tylko w odpowiednim środowisku na części swego zasięgu występowania. W Europie Zachodniej populacje są pofragmentowane[2], a Hyla arborea stanowi rzadkość[6]. Liczebność płaza obniża się jednak nie tylko tam. Spadek liczebności notuje się też w leżącej na wschodzie zasięgu występowania płaza Turcji, co pozostaje w zgodzie z ogólnym trendem populacyjnym[2]. Natomiast w Holandii po osiągnięciu minimum w 1985 populacja powoli zwiększa swą liczebność[49]. W 2009 na Pojezierzu Starogardzkim te skaczące stwierdzono w co drugim stawie[58]. W Polsce występuje na terenie całego kraju, jednak pospolicie tylko na obszarze nizinnym[18]. Trudno jest ją jednakże zaobserwować[10].
Rzekotka drzewna wykazuje dużą wrażliwość na zmiany w środowisku. Wpływają nań fragmentacja lasów, zagajników i łąk, jak również osuszanie i zanieczyszczenie mokradeł[2]. Osuszanie i inwestycje związane z budową dróg wpłynęły niekorzystnie na używane przez rzekotki płytkie, ciepłe, nieeutroficzne stawy pozbawione ryb. Wprowadzanie zmian w roślinności wokół stawów utrudnia płazom migrację pomiędzy zbiornikami wodnymi[53]. Zaznacza się też wpływ drapieżnych ryb[2], eutrofizacji i zanieczyszczenia wód. W zachodniej Szwajcarii negatywną rolę odgrywają też przekształcanie pastwisk i łąk w rejony podmiejskie, plantacje intensywnego rolnictwa i budowa dróg[20]. W kraju tym rzekotkę uznaje się za poważnie zagrożoną, a zasięg występowania płaza w tym kraju jest rozczłonkowany[56]. Lokalne spadki liczebności mogą mieć związek z odłowem i traktowaniem płaza jako zwierzęcia domowego[2]. Prawdopodobieństwo wymarcia lokalnej populacji zależy od wielkości stawu i dostępności okolicznych środowisk leśnych, prawdopodobieństwo zasiedlenia zaś od ilości stawów w okolicy[49].
Badania przeprowadzone w Danii wykazały odchylenia od prawa Hardy’ego-Weinberga, za przyczynę których uchodzi chów wsobny, wpływający negatywnie na stan zdrowia populacji. Fragmentacja środowiska przyczynia się bowiem do spadku różnorodności genetycznej, redukując rozmiary i pogarszając kondycję populacji. Subpopulacje tracą przez nią łączność ze sobą. Zwiększa się rola dryfu genetycznego, jak również możliwość chowu wsobnego, który zmniejsza różnorodność genetyczną, ocenianą przez porównywanie z przewidywaniami czynionymi dzięki wspomnianemu prawu. Rzeczona różnorodność wykazuje korelację z kondycją populacji – jest ona niewielka w populacjach małych, o niedużym stopniu heterozygotyczności, które posiadają też często niewielkie zdolności adaptacyjne. Tymczasem badane populacje przeszły niegdyś przez wąskie gardło. W badaniach tych oceniono 12 loci mikrosatelitarnego DNA i wśród większości loci polimorficznych w niektórych stawach znaleziono też monomorficzne. Wykryto również niedobór heterozygot będący prawdopodobnie efektem nielosowego krzyżowania się, alleli null czy efektu Washlunda. Żadne z loci nie wykazało jednak odchyleń w każdym z ocenianych stawów. Chów wsobny w populacjach, których status oceniano wcześniej korzystnie, osiągał mniejszy poziom[53]. W Holandii natomiast, gdzie populacja przeszła efekt szyjki od butelki w 1985, po przebadaniu 8 polimorficznych (od 2 do 10 alleli) loci mikrosatelitarnych wykryto zaledwie jeden locus monomorficzny w jednej z populacji[49].
Opisywany spadek heterozygotyczności ma niekorzystny wpływ na rzekotki. Chociażby stan larw pozytywnie koreluje z ich heterozygotycznością (w tym masa ciała i długość)[59]. Luquet potwierdził mniejszą masę ciała i gorszy rozwój kijanek z izolowanych populacji, w trudnych warunkach cechowała je również wyższa umieralność. Larwy izolowanych populacji wykazywały również większą zależność rozwoju od zagrażających im drapieżników[44].
Na obniżenie populacji rzekotki drzewnej wpłynęły pestycydy i inne ksenobiotyki. Zagrożenie dla rozwoju larw stanowią estrogeny, wprowadzane do środowiska przez człowieka, w tym EE2 (17α-etynyloestradiol) używane jako środek antykoncepcyjny. Zaburza on determinację płci rzekotki drzewnej. W badaniach pod kierunkiem Ghali znacznie mniej osobników poddanych działaniu E2 przeszło metamorfozę. Obecność hotmonu wpływała także na długość i masę ciała młodocianych rzekotek. O ile w krytycznym okresie po przeobrażeniu prawie połowa osobników umiera, wcześniejszy kontakt z estrogenem zwiększał jeszcze tę liczbę do 62%. Kolejnych kilkanaście tygodni przeżyło tylko 13% (w grupie kontrolnej 28%). Etiopatogeneza nie została dokładnie poznana. Estrogeny, poza tym że wywołują feminizację samców płazów i uszkadzają im jądra[45], prowadzą do odwrócenia płci na żeńską i powstawania osobników hermafrodytycznych[60], mogą powodować rozwój guzów, uszkadzając DNA[45].
Populacje zamieszkujące Jutlandię znajdują się w lepszej kondycji, niż te z wyspy Lolland, na której znacząco spadła ilość odpowiednich dla rzekotki stawów[53]. W Szwajcarii kolejne lokalne wyginięcia przeplatają się z rekolonizacjami[20].
W 1996 gatunkowi przyznano status niższego ryzyka. W 2004 zmieniono go na bliski zagrożenia (NT). Dwa lata później sklasyfikowano go jednak jako najmniejszej troski (LC)[2]. Na niektórych obszarach (np. województwo opolskie) w ogóle nie umieszcza się go w żadnej z kategorii czerwonej listy związanych z zagrożeniem[61]. Wymienia go załącznik II konwencji berneńskiej oraz aneks IV dyrektywy siedliskowej Unii Europejskiej. Figuruje również w wielu krajowych czerwonych księgach czy listach. Chroni go ustawodawstwo wielu krajów[2], między innymi Polski, gdzie podlega ścisłej ochronie gatunkowej[62][63]. Na przykład w Szwajcarii, gdzie uznaje się go za wysoce zagrożony, odpowiednie prawodawstwo wprowadzono już w 1968[20].
Zamieszkuje liczne obszary chronione[2].
W części zasięgu występowania podejmuje się działania mające na celu zmniejszenie śmiertelności tych bezogonowych na drogach. Służą mu również prowadzone w Europie Środkowej programy tworzenia stawów[2]. Podobne działania podjęła Holandia, zwracając również uwagę na siedliska wokół zbiornika[49]. Szwecja podjęła specjalny program odnowy gatunku. Dzięki niemu liczba osobników, wynosząca w 1980 r. 2000 rzekotek, zwiększyła się przez następne 28 lat do 50000[2].
W 2016 opublikowano badanie wykonane metodą PVA (Population Viability Analysis), dotychczas rzadko stosowaną do oceny zagrożonych populacji płazów, wykorzystując izolowaną populację ze stawu w Hanowerze, liczącą około 70 zwierząt. Zwrócono uwagę na negatywny związek między fragmentacją środowiska a stanem genetycznym populacji. W zbadanych 8 loci mikrosatelitarnych stwierdzono od 4 do 7 alleli, średnio 4,9. W WHA1-60 stwierdzono znaczny niedobór heterozygot, gdy inne spełniały prawo Hardy’ego-Weinberga. Analiza wykazała wysokie prawdopodobieństwo wyginięcia w ciągu następnego półwiecza. Jako kluczowy czynnik podano przeżywalność osobników młodocianych. Takim niewielkim populacjom zagraża także chów wsobny. Po wyginięciu staw mógłby zostać ponownie zasiedlony przez inną populację rzekotki drzewnej. Populację mogłaby natomiast uratować imigracja z metapopulacji. Zasugerowano działania ochronne, zwłaszcza zwiększające przeżywalność na wczesnych etapach życia oraz stworzenie korytarzy umożliwiających migracje. W planowaniu należy brać pod uwagę oddziaływania metapopulacyjne[64].
Rzekotka drzewna zostaje często sztandarowym gatunkiem różnych programów ochronnych[2].
Przypisy
[edytuj | edytuj kod]- ↑ a b Hyla arborea, [w:] Integrated Taxonomic Information System (ang.).
- ↑ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac ad ae af ag ah ai aj Hyla arborea, [w:] The IUCN Red List of Threatened Species (ang.).
- ↑ a b c d e f g Matthias Stöck, Sylvain Dubey, Cornelya Klütsch, Spartak N. Litvinchuk, Ulrich Scheidt & Nicolas Perrin. Mitochondrial and nuclear phylogeny of circum-Mediterranean tree frogs from the Hyla arborea group. „Molecular Phylogenetics and Evolution”. 49, s. 1019–1024, 2008. Elsevier. (ang.).
- ↑ a b c d e Sarah A. Smith, Patrick R. Stephens & John J. Wiens. Replicate patterns of species richness, historical biogeography, and phylogeny in Holarctic treefrogs. „Evolution”. 59, s. 2433–2450, 2005. (ang.).
- ↑ a b L. Berset-Brändli, J. Jaquiéry, S. Dubey & N. Perrin. A Sex-Specific Marker Reveals Male Heterogamety in European Tree Frogs. „Molecular Biology and Evolution”. 23, s. 1104-1106, 2006. (ang.).
- ↑ a b c d e f g h i j k l m n o Wilfried Stichmann: Płazy. W: Wilfried Stichmann, Erich Kretzschmar: Zwierzęta. Warszawa: MULTICO Oficyna Wydawnicza, 1998, s. 188, seria: Spotkania z przyrodą. ISBN 83-7073-185-6.
- ↑ Giuseppe Nascetti, Benedetto Lanza, Luciano Bullini. Genetic data support the specific status of the Italian treefrog (Amphibia: Anura: Hylidae). „Amphibia-Reptilia”. 16, s. 215–227, 1995. (ang.).
- ↑ Hyla, [w:] Integrated Taxonomic Information System [dostęp 2011-09-22] (ang.).
- ↑ a b c d e f g Sergio Castellano, Barbara Cuatto, Rosalba Rinella, Alessandra Rosso & Cristina Giacoma. The advertisement call of the European treefrogs (Hyla arborea): a multilevel study of variation. „Ethology”. 108, s. 75–89, 2002. Blackwell Wissenschafts-Verlag. ISSN 0179-1613. (ang.).
- ↑ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac ad ae af ag ah ai aj ak Günter Diesener, Josef Reichholf: Płazy i gady. Warszawa: Świat Książki, 1997, s. 74-77, seria: Leksykon Przyrodniczy. ISBN 83-7129-440-9.
- ↑ Hyla sarda, [w:] Integrated Taxonomic Information System [dostęp 2012-09-10] (ang.).
- ↑ a b c d e Matthias Stöck, Agnès Horn, Christine Grossen, Dorothea Lindtke, Roberto Sermier, Caroline Betto-Colliard, Christophe Dufresnes, Emmanuel Bonjour, Zoé Dumas, Emilien Luquet, Tiziano Maddalena, Helena Clavero Sousa, Iñigo Martinez-Solano, Nicolas Perrin. Ever-Young Sex Chromosomes in European Tree Frogs. „PloS Biology”. 9 (5), s. e1001062, 2011. (ang.).
- ↑ Günter Diesener, Josef Reichholf: Płazy i gady. Warszawa: Świat Książki, 1997, s. 251, seria: Leksykon Przyrodniczy. ISBN 83-7129-440-9.
- ↑ a b Christophe Dufresnes, Youna Bertholet, Jer´ome Wassef, Karim Ghali, Romain Savary, Baptiste Pasteur, Alan Brelsford, Beata Rozenblut-Koscisty, Maria Ogielska, Matthias Stock & Nicolas Perrin. Sex-chromosome differentiation parallels postglacial range expansion in European tree frogs (Hyla arborea). „Evolution”. 68 (12), s. 3445–3456, 2014. researchgate. DOI: 10.1111/evo.12525. (ang.).
- ↑ a b c d e A Brelsford, Dufresnes & N Perrin. High-density sex-specific linkage maps of a European tree frog (Hyla arborea) identify the sex chromosome without information on offspring sex. „Heredity”. 116, s. 177–181, 2016. DOI: 10.1038/hdy.2015.83. (ang.).
- ↑ Alan Brelsford, Matthias Stock, Caroline Betto-Colliard, Sylvain Dubey, Christophe Dufresnes, Hel´ ene Jourdan-Pineau, Nicolas Rodrigues, Romain Savary, Roberto Sermier & Nicolas Perrin. Homologous sex chromosomes in three deeply divergent anuran species. „Evolution”. 67 (8), s. 2434–2440, 2013. researchgate. DOI: 10.1111/evo.12151. (ang.).
- ↑ B Charlesworth & D Charlesworth. The degeneration of Y chromosomes. „Philosophical Transactions of the Royal Society B: Biological Sciences”. 355 (1403), s. 1563–1572, 2000. The Royal Society. DOI: 10.1098/rstb.2000.0717. (ang.).
- ↑ a b c d e f g h i j k l m n o p q r s t u v w x y z Marian Młynarski: Płazy i gady Polski. Warszawa: Państwowe Zakłady Wydawnictw Szkolnych, 1966, s. 40–41.
- ↑ a b c d e f g h i j k l m n o p q Ulrich Gruber: Płazy i gady. Gatunki środkowoeuropejskie. MULTICO, s. 28–29, seria: Świat przyrody.
- ↑ a b c d e f g Jerome Pellet, Antoine Guisan & Nicolas Perrin. A concentric analysis of the impact of urbanization on the threatened European tree frog in an agricultural landscape. „Conservation Biology”. 18, s. 1599-1606, 2004-12. (ang.).
- ↑ a b c d e R. Márquez, C. Moreira, J.P.S. do Amaral, J.M. Pargana & E.G. Crespo. Sound pressure level of advertisement calls of Hyla meridionalis and Hyla arborea. „Amphibia-Reptilia”. 26, s. 391–395, 2005. Koninklijke Brill NV. (ang.).
- ↑ a b c Pasqualina Kyriakopoulou-Sklavouno & Ivana Grumiro. Body size and age assessment among breeding populations of the tree frog Hyla arborea in northern Greece. „Amphibia-Reptilia”. 23, s. 219-224, 2002. (ang.).
- ↑ a b c d e f g Thomas W.P. Friedl, Georg M. Klump. Some aspects of population biology in the European treefrog, Hyla arborea. „Herpetologica”. 53 (3), s. 312–330, 1997. JSTOR: 3893341. (ang.).
- ↑ a b c d e f g Doris Gomez, Christina Richardson, Thierry Lengagne, Sandrine Plenet, Pierre Joly, Jean-Paul Léna & Marc Théry. The role of nocturnal vision in mate choice: females prefer conspicuous males in the European tree frog (Hyla arborea). „Proceedings of the Royal Society B”. 276, s. 2351–2358, 2009-03-25. DOI: 10.1098/rspb.2009.0168. (ang.).
- ↑ a b Hans Ingolf Nielsen. Color and color adaptation of the European tree frog, Hyla arborea. „Journal of Experimental Zoology”. 211, s. 143, 1980-02. Wiley-Liss, Inc., A Wiley Company. DOI: 10.1002/jez.1402110204. (ang.).
- ↑ Đorđević, S., Simović, A., Krizmanić, I., & Tomović, L. Colour variations in the European tree frog, Hyla arborea (Linnaeus, 1758), from two small adjacent ponds in the Vojvodina province, Serbia. „Ecologica Montenegrina”. 5, s. 18–21, 2016. (ang.).
- ↑ Hans Ingolf Nielsen. Ultrastructural changes in the dermal chromatophore unit of Hyla arborea during color change. „Cell and Tissue Research”. 194, s. 405–418, 1978. DOI: 10.1007/BF00236162. (ang.).
- ↑ G. Delfino, R. Brizzi, C. Calloni. Serous Cutaneous Glands in the Tree-frog Hyla arborea arborea (L.): Origin, Ontogenetic Evolution, and Possible Functional Implications of the Secretory Granule Substructure. „Acta Zoologica”. 75, s. 27–36, 1994-01. DOI: 10.1111/j.1463-6395.1994.tb00959.x. (ang.).
- ↑ Günter Diesener, Josef Reichholf: Płazy i gady. Warszawa: Świat Książki, 1997, s. 78, seria: Leksykon Przyrodniczy. ISBN 83-7129-440-9.
- ↑ Lucyna Goniakowska-Witalińska. Lung of the tree frog, Hyla arborea L.. „Anatomy and embryology”. 174, s. 379-389, 1986. DOI: 10.1007/BF00698788. (ang.).
- ↑ a b c Julia L. Desprat, Loïc Teulier, Sara Puijalon, Adeline Dumet, Caroline Romestaing, Glenn J. Tattersall, Thierry Lengagne, Nathalie Mondy. Doping for sex: Bad for mitochondrial performances? Case of testosterone supplemented Hyla arborea during the courtship period. „Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology”. 209, s. 74–83, 2017. Elsevier. (ang.).
- ↑ Jérôme Pellet, Luca Rechsteiner, Anja K. Skrivervik, Jean-François Zürcher & Nicolas Perrin. Use of the Harmonic Direction Finder to study the terrestrial habitats of the European tree frog (Hyla arborea). „Amphibia-Reptilia”. 27, s. 138–142, 2006. (ang.).
- ↑ a b c d Éva-Hajnalka Kovács, István Sas, Severus-Daniel Covaciu-Marcov, Tibor Hartel, Diana Cupsa, Marius Groza. Seasonal variation in the diet of a population of Hyla arborea from Romania. „Amphibia-Reptilia”. 28, s. 485–491, 2007. (ang.).
- ↑ a b c d e f g h i j Thomas W.P. Friedl. Individual Male Calling Pattern and Male Mating Success in the European Treefrog (Hyla arborea): Is there Evidence for Directional or Stabilizing Selection on Male Calling Behaviour?. „Ethology”. 112, s. 116–126, 2006. Wiley Online Library. Blackwell Verlag. DOI: 10.1111/j.1439-0310.2005.01132.x. (ang.).
- ↑ a b T.U. Grafe & J. Thein. Energetics of calling and metabolic substrate use during prolonged exercise in the European treefrog Hyla arborea. „Journal of Comparative Physiology B: Biochemical, Systemic and Environmental Physiology”. 171, s. 69–76, 2001. DOI: 10.1007/s003600000151. (ang.).
- ↑ a b Andreas Knorr. Central control of mating call production and spawning in the tree frog Hyla arborea savignyi (Audouin): Results of electrical stimulation of the brain. „Behavioural Processes”. 1, s. 295–317, 1976-11-08. Elsevier B.V. DOI: 10.1016/0376-6357(76)90012-7. (ang.).
- ↑ T. Ulmar Grafe & Ivonne Meuche. Chorus tenure and estimates of population size of male European tree frogs Hyla arborea: implications for conservation. „Amphibia-Reptilia”. 26, s. 437-444, 2005. (ang.).
- ↑ a b c d e Julia L. Desprat, Nathalie Mondy & Thierry Lengagne. Does testosterone affect foraging behavior in male frogs?. „Hormones and Behavior”. 90, s. 25–30, 2017. Elsevier. (ang.).
- ↑ Julio Pérez, Michael A. Cohen, Darcy B. Kelley, Androgen receptor mRNA expression in Xenopus laevis CNS: Sexual dimorphism and regulation in laryngeal motor nucleus, „Developmental Neurobiology”, 30 (4), 1996, s. 556–568, DOI: 10.1002/(SICI)1097-4695(199608)30:4<556::AID-NEU10>3.0.CO;2-D (ang.).
- ↑ a b Günter Diesener, Josef Reichholf: Płazy i gady. Warszawa: Świat Książki, 1997, s. 248, seria: Leksykon Przyrodniczy. ISBN 83-7129-440-9.
- ↑ Andreas Chovanec. The influence of tadpole swimming behaviour on predation by dragonfly nymphs. „Amphibia-Reptilia”. 13, s. 341–349(9), 1992. BRILL. (ang.).
- ↑ a b Gad Degani. Growth and behaviour of six species of amphibian larvae in a winter pond in Israel. „Hydrobiologia”. 140, s. 5–10, 1986. Springer.
- ↑ Adam Hermaniuk, Katarzyna Sidoruk & Włodzimierz Chętnicki: Wybrane aspekty biologii rozrodu płazów. Uniwersytet w Białymstoku. [dostęp 2011-12-22].
- ↑ a b E. Luquet, J.P. Lena, P. David, P. Joly, T. Lengagne, N. Perrin & S. Plénet. Consequences of genetic erosion on fitness and phenotypic plasticity in European tree frog populations (Hyla arborea). „Journal of Evolutionary Biology”, s. 99–110, 2011. Wiley Online Library. DOI: 10.1111/j.1420-9101.2010.02138.x. (ang.).
- ↑ a b c Karim Ghali, Julien Leuenberger, Michel Ansermet , Nicolas Perrin & Christophe Dufresnes. Toxic effects of estradiol E2 on development in the European tree frog (Hyla arborea). „Herpetology Notes”. 9, s. 249–253, 2016. (ang.).
- ↑ D.A. Hooijer: The fossil vertebrates of Ksar'Akil, a Palaeolithic rock shelter in the Lebanon. s. 6.
- ↑ Roger Bour, Marc Cheylan, Pierre-André Crochet, Philippe Geniez, Robert Guyetant, Patrick Haffner, Ivan Ineich, Guy Naulleau, Anne-Marie Ohler & Jean Lescure. Liste taxinomique actualisée des Amphibiens et Reptiles de France. „Bull. Soc. Herp. Fr.”. 126, s. 37–43, 2008. (fr.).
- ↑ Miguel A. Carretero, Enrique Ayllón & Gustavo Llorente: Lista patrón de los anfibios y reptiles de España (actualizada a julio de 2011). [dostęp 2013-02-12]. [zarchiwizowane z tego adresu (2014-02-22)]. (hiszp.).
- ↑ a b c d e f g h Paul Arens, Rob Bugter, Wendy van’t Westende, Ronald Zollinger, Jan Stronks. Microsatellite variation and population structure of a recovering Tree frog (Hyla arborea L.) metapopulation. „Conservation Genetics”. 7, s. 825–834, 2006. Springer. DOI: 10.1007/s10592-005-9112-7. (ang.).
- ↑ David D. Marsh, Peter C. Trenham. Metapopulation dynamics and amphibian conservation. „Conservation Biology”. 15, 2001-02. (ang.).
- ↑ Claire C. Vos & Anton H.P. Stumpel. Comparison of habitat-isolation parameters in relation to fragmented distribution patterns in the tree frog (Hyla arborea). „Landscape Ecology”. 11, s. 203, 1996. DOI: 10.1007/BF02071811. (ang.).
- ↑ a b Josh Van Buskirk. Local and landscape influence on amphibian occurrence and abundance. „Ecology”. 86, s. 1936–1947, 2005. Ecological Society of America. DOI: 10.1890/04-1237. (ang.).
- ↑ a b c d Liselotte W. Andersen, Kåre Fog & Christian Damgaard. Habitat fragmentation causes bottlenecks and inbreeding in the European tree frog (Hyla arborea). „Proceedings of The Royal Society”. 271, s. 1293–1302, 2004-05-15. The Royal Society. DOI: 10.1098/rspb.2004.2720. (ang.).
- ↑ Jiate Liu. Dispersal and local abundances of the predatory edible frog (Pelophylax esculentus) in Scania – A potential threat to the vulnerable green tree frog (Hyla arborea)?. „BION01”. 20162, 2017. (ang.).
- ↑ Günter Diesener, Josef Reichholf: Płazy i gady. Warszawa: Świat Książki, 1997, s. 274, seria: Leksykon Przyrodniczy. ISBN 83-7129-440-9.
- ↑ a b Jerome Pellet, Sophie Hoehn & Nicolas Perrin. Multiscale determinants of tree frog (Hyla arborea L.) calling ponds in western Switzerland. „Biodiversity and Conservation”. 00, s. 1–9, 2003. Kluwer Academic Publishers.. (ang.).
- ↑ Düşen Serdar, Mehmet Öz. Helminth Parasites of the Tree Frog, Hyla arborea (Anura: Hylidae) from Southwest Turkey. „Comparative Parasitology”. 71, s. 258–261, 2004. DOI: 10.1654/4123. (ang.).
- ↑ Tomasz Hetmański, Anna Jarosiewicz & Mariusz Kasprzak. Płazy Pojezierza Starogardzkiego. „Słupskie Prace Biologiczne”. 6, 2009.
- ↑ E. Luquet, P. David, J.-P. Lena, P. Joly, L. Konecny, C. Dufresnes, N. Perrin & S. Plenet. Heterozygosity–fitness correlations among wild populations of European tree frog (Hyla arborea) detect fixation load. „Molecular Ecology”. 20, s. 1877–1887, 2011. Blackwell Publishing Ltd. DOI: 10.1111/j.1365-294X.2011.05061.x. (ang.).
- ↑ Stephanie Tamschick, Beata Rozenblut-Kościsty, Maria Ogielska, Andreas Lehmann, Petros Lymberakis, Frauke Hoffmann, Ilka Lutz, Werner Kloas & Matthias Stöck. Sex reversal assessments reveal different vulnerability to endocrine disruption between deeply diverged anuran lineages. „Scientific Reports”. 6, s. 23825, 2016. DOI: 10.1038/srep23825. (ang.).
- ↑ Grzegorz Hebda, Adam Kuńka, Renata Paszkiewicz & Rafał Szkudlarek. Czerwona lista kręgowców (Płazy Amphibia, Gady Reptilia, ptaki Aves, ssaki Mammalia) województwa opolskiego. „Nature Journal”. 37, 2004.
- ↑ Dz.U. 2014 poz. 1348 Rozporządzenie Ministra Środowiska z dnia 6 października 2014 r. w sprawie ochrony gatunkowej zwierząt. [dostęp 2015-02-02].
- ↑ Rozporządzenie Ministra Środowiska z dnia 16 grudnia 2016 r. w sprawie ochrony gatunkowej zwierząt (Dz.U. z 2016 r. poz. 2183).
- ↑ Auffarth, J, Krug, A, Pröhl, H & Jehle, R. A genetically-informed population viability analysis reveals conservation priorities for an isolated European tree frog (Hyla arborea) population. „Salamandra”, 2016. ISSN 0036-3375. (ang.).
