288496840-A ÁGUA COMO SOLVENTE e AMINOÁCIDOS
288496840-A ÁGUA COMO SOLVENTE e AMINOÁCIDOS
Enviado por
helenfeliciapintodornelesDireitos autorais:
Formatos disponíveis
288496840-A ÁGUA COMO SOLVENTE e AMINOÁCIDOS
288496840-A ÁGUA COMO SOLVENTE e AMINOÁCIDOS
Enviado por
helenfeliciapintodornelesDireitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Direitos autorais:
Formatos disponíveis
288496840-A ÁGUA COMO SOLVENTE e AMINOÁCIDOS
288496840-A ÁGUA COMO SOLVENTE e AMINOÁCIDOS
Enviado por
helenfeliciapintodornelesDireitos autorais:
Formatos disponíveis
A ÁGUA COMO SOLVENTE
Solubilidade = Interação soluto / solvente
Água = solvente universal - maior quantidade de solventes
Semelhante dissolve semelhante polar X polar (H2O)
não-polar X não-polar (óleo)
Polar – hidrofílicos Não-polar – hidrofóbicos
Os solventes polares enfraquecem as forças de atração entre
íons de carga oposta (NaCl H2O Na+ + Cl- )
Um íon imerso em um solvente polar atrai as extremidades da
carga oposta dos dipolos do solvente. Íons solvatados
(água – hidratados).
Na+ Cl-
A maioria das moléculas biológicas possui segmentos polares
e apolares – anfifílicas ou anfipáticas. Estas tendem a formar
agregados ordenados estruturalmente: as MICELAS.
As micelas são estáveis pelo efeito hidrofóbico. H 2O exclui
grupos hidrofóbicos.
Importância biológica = membranas celulares – bicamada com
propriedades físicas e químicas semelhantes.
PROPRIEDADES QUÍMICAS DA ÁGUA
H2O – ambiente intra e extracelular; determina o comportamento de
outras moléculas em solução.
A) IONIZAÇÃO DA ÁGUA
A água é uma molécula neutra com tendência a ionizar-se:
H2O H+ + OH-
Equação – constante de dissociação (K):
K = [H+] [OH-]
[H2O]
B) QUÍMICA ÁCIDO-BASE
Os íons H+ + OH- são FUNDAMENTAIS para as reações
bioquímicas. Moléculas biológicas (proteínas e ácidos nucléicos)
possuem grupos que agem como ácidos ou bases, que influenciam
no pH. Estes são essenciais para o entendimento do papel biológico
de muitas moléculas.
C) TAMPÕES
Soluções elaboradas a partir de um ácido fraco com sua base
conjugada sob a forma de um sal para manter o pH constante.
Ex.: H2CO3/ HCO3-; NH4+/NH3.
O sistema biológico regulado por tampão mais conhecido é o
tamponamento do sangue, que mantém o pH sangüíneo em torno de
7,4. Principais tampões do sangue: fosfato, proteínas e bicarbonato.
AMINOÁCIDOS
A) CARACTERÍSTICAS GERAIS
São as unidades fundamentais das proteínas. As proteínas são
formadas basicamente por 20 aminoácidos essenciais. Podem
aparecer outros aminoácidos em alguns tipos de proteínas.
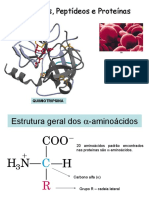
B) ESTRUTURA QUÍMICA GERAL
Os 20 aminoácidos essenciais têm características estruturais
em comum:
- Carbono central quase sempre assimétrico (4 ligantes
diferentes;
- Nas proteínas encontramos apenas L-aminoácidos
(grupamento ácido na esquerda).
Ligados ao C central encontramos:
Grupamento carboxila (ácido);
Grupamento amina (base);
Átomo de hidrogênio
Um radical “R” (variável)
O radical “R” diferencia um aminoácido do outro (cadeia lateral).
NH2 NH2
HO
C C R = HOOC C R
O
H H
Radical “R” – polaridade e grau de ionização dos aminoácidos
C) CLASSIFICAÇÃO DOS AMINOÁCIDOS
São classificados segundo a polaridade do radical “R”:
1. Aminoácidos com radical “R” apolar:
Radical “R” geralmente apenas C e H. São todos hidrofóbicos:
Alanina
Glicina
Valina
Leucina
Isoleucina
Prolina
Fenilalanina
Triptofano
Metionina
2. Aminoácidos com radical “R” polar não carregado:
Radicais contendo hidroxilas, sulfidrilas e grupamentos amida.
São todos hidrofílicos:
Serina – “R” com função álcool
Treonina - “R” com função álcool
Cisteína - “R” = radical sulfidrila
Tirosina - “R” com grupamento fenol
Aspargina - “R” com função amida
Glutamina - “R” com função amida
3. Aminoácidos com radical “R” polar carregado:
Aminoácidos diamino e monocarboxílicos:
Lisina
Arginina
Histidina
4. “R” carregado negativamente:
Aminoácidos monoamino e dicarboxílicos:
Ácido aspártico
Ácido glutâmico
D) AMINOÁCIDOS EM SOLUÇÃO AQUOSA
Têm caráter anfótero: em solução aquosa tanto ácido como
base. grupamento carboxila: em meio aquoso, perde próton:
NH2 NH2
HOOC C R -
OOC C R + H+
H H
Grupamento amino: em meio aquoso, recebe um próton:
NH2 NH3+
H+ + HOOC C R HOOC C R
H H
Ponto isoelétrico - valor de pH onde as cargas elétricas do
aminoácido se igualam.
E) CURVA DE TITULAÇÃO
- Ponto 1: Totalmente protonado
- Ponto 2: [NH3+CHRCOOH] = [NH3+CHRCOO-]
- Ponto 3: Ponto isoelétrico [NH3+CHRCOO-]
- Ponto 4: [NH3+CHRCOO-] = [NH2CHRCOO-]
- Ponto 5: Totalmente desprotonado
F) DISTÚRBIOS NAS ENZIMAS DE SÍNTESE E DEGRADAÇÃO
1. Fenilcetonúria (PKU) - Defeito na enzima fenilalanina
hidroxilase (Phe Tyr). Pode ser tbm deficiência nas enzimas que
BH4
associadas à tetrahidrobiopterina (BH4), um cofator da fenilalanina
hidroxilase. Há o acúmulo de Phe no plasma – causa mais freqüente
de retardo mental 1: 10.000. Tyr precursora das catecolaminas no
SNC.
PKU tipo I – ausência da enzima fenilalanina hidroxilase
PKU tipo II – deficiência da enzima fenilalanina hidroxilase
PKU tipo III – hiperfenilalaninemia transitória – atraso na síntese no
fígado.
Tratamento da PKU:
Dieta pobre em Phe
Adição de Tyr
Adição de L-DOPA e 5-OH-Triptofano
Início até o 3º mês de vida
2. Tirosinemia – Distúrbios metabólicos nas enzimas que
catabolizam a tirosina.
Tipo I – Deficiência na enzima fumarilacetoacetato hidrolase.
Acúmulo de Tyr no plasma. Desvia rota para produção de succinil
acetona e diminui succinil-CoA, prejudicando a síntese da
hemoglobina e mioglobina.
Tipo II – Deficiência na enzima tirosina-aminotransferase que
catalisa a transferência do grupamento amino para o glutamato.
3. Hiperglicinemia - Gly aumenta 10x. Trata-se de uma
hiperglicemia não cetótica. Afeta o desenvolvimento do SNC.
4. Hipercolinemia, hiperleucinemia e hiperisoleucinemia –
distúrbios metabólicos nas enzimas que catabolizam colina, Leu e
Iso. Prejudicam o crescimento infantil e causam retardo mental.
Tratamento – Retirada dos 3 aminácidos da dieta.
5. Doença do Xarope do Bordo – Bloqueio na degradação de
Leu, Iso e Val. Aumento na concentração de ceto-ácidos. Doença
grave, com morte rápida, logo após o nascimento.
6. Homocistinúria – erros no metabolismo de aas que estão
associados à inativação de neurotransmissores e à síntese de
creatinina e vitamina B12.
Tipo I – Deficiência da cistationina-sintase – causa aumento de Met e
hemocisteína no plasma, tecidos e urina. (Aterosclerose,
osteoporose, retardo mental em 50 % dos casos).
Tratamento – Diminuição da Met e aumento da Cys na dieta e
complementação com piridoxal fosfato (importante cofator).
Tipo II – Defeito na ressíntese da Met. Reduz a formação da vitamina
B12, aumenta cistationina e diminui Met. Geralmente assintomático.
7. Histidinemia – Defeito na enzima histidase que converte His
em urocaminato. Ocorrem níveis elevados de His no sangue e urina.
Retira CO2 dos tecidos.
Tratamento – Retirada de His da dieta.
Você também pode gostar
- Resistência Dos Materiais - Aula 02Documento20 páginasResistência Dos Materiais - Aula 02Lucas XavierAinda não há avaliações
- Princípios de Bioquímica de Lehninger 6 EdiçãoDocumento53 páginasPrincípios de Bioquímica de Lehninger 6 EdiçãoAldelainy Menezes Da SilvaAinda não há avaliações
- Compostos CarboniladosDocumento79 páginasCompostos CarboniladoslayzAinda não há avaliações
- Aula 8 Equilibrio IonicoDocumento80 páginasAula 8 Equilibrio IonicoLeonardo MacielAinda não há avaliações
- Aminoácidos E Peptídeos Professor Rafael TrevisanDocumento53 páginasAminoácidos E Peptídeos Professor Rafael TrevisanFabricio PortellaAinda não há avaliações
- Aula 2 - AminoácidosDocumento53 páginasAula 2 - AminoácidosRafael MagalhãesAinda não há avaliações
- Aula 04 Aminoácidos e PeptídeosDocumento56 páginasAula 04 Aminoácidos e PeptídeosHeliton WiggersAinda não há avaliações
- Aminoácidos e ProteínasDocumento50 páginasAminoácidos e ProteínasRafael faruqueAinda não há avaliações
- Propriedades Químicas Dos Compostos Orgânicos (Acidez e Basicidade) - 1Documento13 páginasPropriedades Químicas Dos Compostos Orgânicos (Acidez e Basicidade) - 1Henrique AguiarAinda não há avaliações
- Aula de AminoácidosDocumento38 páginasAula de AminoácidoslahfmchAinda não há avaliações
- Reações Ácidos CarboxilicosDocumento31 páginasReações Ácidos CarboxilicosNick AllenAinda não há avaliações
- Aula 1Documento16 páginasAula 1Maiara SousaAinda não há avaliações
- Aula 21 - Biosíntese de Aminoácidos e Catabolismo 2020-1Documento21 páginasAula 21 - Biosíntese de Aminoácidos e Catabolismo 2020-1GiovannaAinda não há avaliações
- Funções Inorgânicas PDFDocumento8 páginasFunções Inorgânicas PDFGustavo Baccho Jorge FilhoAinda não há avaliações
- Aula de MetabolismoBarbara1Documento30 páginasAula de MetabolismoBarbara1Juliana NunesAinda não há avaliações
- Aula 03 PH e Tampao Bio FarmáciaDocumento81 páginasAula 03 PH e Tampao Bio FarmáciaChristopher IngramAinda não há avaliações
- Todas As PerguntasDocumento160 páginasTodas As PerguntasPatriciaAinda não há avaliações
- Resoluçao Aminoacidos e ProteinasDocumento4 páginasResoluçao Aminoacidos e ProteinasLeo LopesAinda não há avaliações
- Slides ConclusãoDocumento31 páginasSlides Conclusãootavio augusto hegler silvaAinda não há avaliações
- 1 - Estrutura - Função AminoacidosDocumento38 páginas1 - Estrutura - Função AminoacidosluisacazarolliAinda não há avaliações
- AminoacidosDocumento30 páginasAminoacidosEvelin Oliveira100% (4)
- Alcoois e Fenois - Resumo - 2023Documento7 páginasAlcoois e Fenois - Resumo - 2023carsoninacioinacioAinda não há avaliações
- Gabarito Estudo Dirigido Aminoácidos e PeptídeosDocumento19 páginasGabarito Estudo Dirigido Aminoácidos e PeptídeosUeguida SilvaAinda não há avaliações
- 08 Funções Inorgânicas I - Prof. Lucas EpifanioDocumento4 páginas08 Funções Inorgânicas I - Prof. Lucas Epifaniotiago balieiroAinda não há avaliações
- plc0013 15Documento18 páginasplc0013 15Eric FerreiraAinda não há avaliações
- 02 Aminoacidos (2 Por Pagina)Documento16 páginas02 Aminoacidos (2 Por Pagina)Stella Indiukov dos SantosAinda não há avaliações
- Estudo PH e TampõesDocumento3 páginasEstudo PH e TampõesAndré LuisAinda não há avaliações
- Química InorgânicaDocumento8 páginasQuímica Inorgânicaandrielle de jesusAinda não há avaliações
- Bioquímica 2Documento9 páginasBioquímica 2HansMikuAinda não há avaliações
- Resumo-4 - Álcool, Fenol, Éter e Seus Análogos Sulfurados PDFDocumento10 páginasResumo-4 - Álcool, Fenol, Éter e Seus Análogos Sulfurados PDFNairilleneAinda não há avaliações
- Prática 1 - Titulação de AminoácidosDocumento10 páginasPrática 1 - Titulação de Aminoácidosrafaela dibAinda não há avaliações
- Aula 07.funções InorgânicasDocumento34 páginasAula 07.funções InorgânicasFlávio RaíqueAinda não há avaliações
- Equacã - o Quimica 2 1Documento9 páginasEquacã - o Quimica 2 1Osvaldo EmanuelAinda não há avaliações
- AMINOÁCIDOSDocumento4 páginasAMINOÁCIDOS2022104560Ainda não há avaliações
- Água, PH, Solução TampãoDocumento14 páginasÁgua, PH, Solução TampãoTaysa Mierzwa BatistaAinda não há avaliações
- Química Orgânica: Curso de Bacharelado em Engenharia Prof. Rômulo MartinsDocumento45 páginasQuímica Orgânica: Curso de Bacharelado em Engenharia Prof. Rômulo MartinsRodrigo SantosAinda não há avaliações
- Lição7 Ácidos Carb ÉsteresDocumento24 páginasLição7 Ácidos Carb ÉsteresJosé SantosAinda não há avaliações
- Química Orgânica LCE 118 1Documento87 páginasQuímica Orgânica LCE 118 1DouglasAinda não há avaliações
- APOSTILA - BioquímicaDocumento16 páginasAPOSTILA - BioquímicaAlimanokoAinda não há avaliações
- Curso Básico de Química 5Documento16 páginasCurso Básico de Química 5RodolfoAinda não há avaliações
- QUIMICDocumento13 páginasQUIMICHermenegildo Carlos joão tarruaAinda não há avaliações
- Aula 3 F Aminoacidos Una 12.2024Documento60 páginasAula 3 F Aminoacidos Una 12.2024andredimande27Ainda não há avaliações
- Aula 05 - Aminoácidos, Peptídeos e ProteínasDocumento70 páginasAula 05 - Aminoácidos, Peptídeos e ProteínasFrancislene Silveira SucupiraAinda não há avaliações
- Ficha de Leitura - Ácidos Carboxílicos e ÉsteresDocumento5 páginasFicha de Leitura - Ácidos Carboxílicos e ÉsteresCosta Guilherme JoséAinda não há avaliações
- Química RG - Funções OxigenedasDocumento5 páginasQuímica RG - Funções OxigenedasQuimica Passei100% (2)
- Cetonas, Acidos Carboxilicos e AldeidosDocumento9 páginasCetonas, Acidos Carboxilicos e AldeidosAlfredo Zacarias Feduca AzcAinda não há avaliações
- Aula 2. AminoácidosDocumento14 páginasAula 2. Aminoácidoskmepina netoAinda não há avaliações
- 4.aminoacidos e Proteinas Parte IDocumento44 páginas4.aminoacidos e Proteinas Parte IGlaucio AlmeidaAinda não há avaliações
- Resumo de Bioquímica M1 - TAINE FREITASDocumento18 páginasResumo de Bioquímica M1 - TAINE FREITAStaineborgesfreitasAinda não há avaliações
- Reações Ácidos Carboxílicos 1Documento58 páginasReações Ácidos Carboxílicos 1Maysa Thais PellenzAinda não há avaliações
- Funções Organicas OxigenadasDocumento69 páginasFunções Organicas OxigenadasKaroline GonçalvesAinda não há avaliações
- Aula 1 Aminoácidos Peptídeos e ProteínasDocumento63 páginasAula 1 Aminoácidos Peptídeos e ProteínaspollancorreaAinda não há avaliações
- Fundamentos de Bioquímica - Introdução A Química e ÁguaDocumento38 páginasFundamentos de Bioquímica - Introdução A Química e Águacarlaed.silvaAinda não há avaliações
- Quimica Dos Compostos Organicos II Aula 7Documento18 páginasQuimica Dos Compostos Organicos II Aula 7marceloAinda não há avaliações
- Funções InorganicasDocumento40 páginasFunções InorganicasFelipe CabralAinda não há avaliações
- Química Da CélulaDocumento21 páginasQuímica Da CélulaJoão Henrique Araújo BatistaAinda não há avaliações
- AMINOACIDOSDocumento127 páginasAMINOACIDOSRoberto MenecesAinda não há avaliações
- 2 - Aminoacidos - 1112Documento35 páginas2 - Aminoacidos - 1112Marta Demetrion CunhaAinda não há avaliações
- Apostila Química Orgânica: Terpenos E Rotas De SínteseNo EverandApostila Química Orgânica: Terpenos E Rotas De SínteseAinda não há avaliações
- Apostila - Combate A Princípios de Incêndio - EADDocumento26 páginasApostila - Combate A Princípios de Incêndio - EADMilena LimaAinda não há avaliações
- Capitulo 3 - Extracao e Refino de Oleo VegetalDocumento25 páginasCapitulo 3 - Extracao e Refino de Oleo VegetalFilipe CruzAinda não há avaliações
- Ficha Técnica - Techcrete Admix Ultra - 2021Documento2 páginasFicha Técnica - Techcrete Admix Ultra - 2021Leonardo Otto Coutinho100% (1)
- 45.0000xxxxx-xx - Produtos de LimpezaDocumento18 páginas45.0000xxxxx-xx - Produtos de LimpezaViviane MartinsAinda não há avaliações
- Tabela InoxDocumento12 páginasTabela InoxvictoreijimoriishitaAinda não há avaliações
- Reação Química. Transf - Quimicas Calor e LuzDocumento22 páginasReação Química. Transf - Quimicas Calor e LuzMariana AntunesAinda não há avaliações
- Absorção de CO2Documento12 páginasAbsorção de CO2Camila CarneiroAinda não há avaliações
- RN15 - Comp. B P Polidura Polipiso Massa Raspagem - 8220750Documento10 páginasRN15 - Comp. B P Polidura Polipiso Massa Raspagem - 8220750Liliane BicalhoAinda não há avaliações
- Prova de Ciências 6° Ano 2024Documento1 páginaProva de Ciências 6° Ano 2024lucieneAinda não há avaliações
- A-L 3 Densidade 11ºanoDocumento3 páginasA-L 3 Densidade 11ºanoLucilia PereiraAinda não há avaliações
- Ficha Técnica - Policloreto de Alumínio 10 (CSM)Documento1 páginaFicha Técnica - Policloreto de Alumínio 10 (CSM)jlinhares.engAinda não há avaliações
- Mapa Mental de BioquímicaDocumento1 páginaMapa Mental de BioquímicagustavoAinda não há avaliações
- Chemtreat Ti174Documento3 páginasChemtreat Ti174Thiago BorgesAinda não há avaliações
- RELATÓRIO 2 (PREPARO DE SOLUÇÕES NaOH)Documento10 páginasRELATÓRIO 2 (PREPARO DE SOLUÇÕES NaOH)Matheus EugenioAinda não há avaliações
- Inu-Inu No Mi Modelo Skoll e HatiDocumento17 páginasInu-Inu No Mi Modelo Skoll e HatiEduardo SiscouttoAinda não há avaliações
- Atividade de Pesquisa Pintura e Revestimento Marcos Eurico Da SilvaDocumento2 páginasAtividade de Pesquisa Pintura e Revestimento Marcos Eurico Da SilvaMarcos EuricoAinda não há avaliações
- Lista de Sobre Teoria Atómica e Estrutura Da Materia, Ligação Química e Termodinâmica QuímicaDocumento6 páginasLista de Sobre Teoria Atómica e Estrutura Da Materia, Ligação Química e Termodinâmica QuímicaRafael faruqueAinda não há avaliações
- Levantamento PapiloscopicoDocumento71 páginasLevantamento PapiloscopicoGabrielle CamposAinda não há avaliações
- Estudo Da Composição Química Dos ÓleosDocumento68 páginasEstudo Da Composição Química Dos ÓleosCarol LacerdaAinda não há avaliações
- Lopez 2016Documento76 páginasLopez 2016Rauny Vizoto FerreiraAinda não há avaliações
- Tutela 80W90Documento14 páginasTutela 80W90Breno brefigueiredoAinda não há avaliações
- Atividade Experimental FotossínteseDocumento2 páginasAtividade Experimental Fotossínteseelisabete marinhoAinda não há avaliações
- Atividade Avaliativa 2º Ano - 1º Bim - Funções InorgânicasDocumento2 páginasAtividade Avaliativa 2º Ano - 1º Bim - Funções InorgânicasPriscila TibúrcioAinda não há avaliações
- Trabalho 2-Determinação Do Acido Acetico em VinagreDocumento2 páginasTrabalho 2-Determinação Do Acido Acetico em VinagreMário CalveteAinda não há avaliações
- TABELADocumento6 páginasTABELAwanderley ferreira de souzaAinda não há avaliações
- CienciasDocumento5 páginasCienciasRaquel NogueiraAinda não há avaliações
- Tratamento de Efluentes Cianetados PDFDocumento11 páginasTratamento de Efluentes Cianetados PDF23tsuki32Ainda não há avaliações
- Relatório 4 LabDocumento7 páginasRelatório 4 LabFernanda SilvaAinda não há avaliações