P1-Hidrolisis de Carbohidratos
P1-Hidrolisis de Carbohidratos
Uploaded by
gOnZo_86Copyright:
Available Formats
P1-Hidrolisis de Carbohidratos
P1-Hidrolisis de Carbohidratos
Uploaded by
gOnZo_86Original Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Copyright:
Available Formats
P1-Hidrolisis de Carbohidratos
P1-Hidrolisis de Carbohidratos
Uploaded by
gOnZo_86Copyright:
Available Formats
Universidad Nacional Autónoma de México
FACULTAD DE QUIMICA
6 CH
2 OH CH 2 OH CH 2 OH CH 2 OH
QUIMICA ORGANICA III
5 O O O O
H H H H H H H H
PRACTICA 1:
Nonreducing H H H H Reducing
4 1 4 1 4 1 4 1
end OH H OH H OH H OH H end
O O O O
3 2
H OH H OH H OH H OH
(a) amylose
"HIDROLISIS DE H
6 CH
H
2 OH
O
H
CARBOHIDRA-
4 1
OH H
( 1n 6)
O Amylose
branch
Branch H OH point
O
Reducing
TOS"
A
6 CH ends
2
O Nonreducing
H H H
ends
4 1 Amylopectin
OH H
O O
Main H OH
chain
(b) (c)
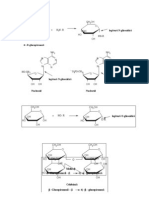
FIGURE 7–15 Amylose and amylopectin, the polysaccharides of to occur in starch granules. Strands of amylopectin (red) form double-
starch. (a) A short segment of amylose, a linear polymer of D -glucose helical structures with each other or with amylose strands (blue).
residues in ( 1n 4) linkage. A single chain can contain several thou- Glucose residues at the nonreducing ends of the outer branches are
sand glucose residues. Amylopectin has stretches of similarly linked removed enzymatically during the mobilization of starch for energy
residues between branch points. (b) An ( 1n 6) branch point of amy- production. Glycogen has a similar structure but is more highly
lopectin. (c) A cluster of amylose and amylopectin like that believed branched and more compact.
ALUMNO:
Gonzalo Roque Flores
GRUPO: 10 LABORATORIO: 2-B
Jueves 1o:00-13:00 hrs.
PROFESOR:
David Cruz Cruz
Semestre 2011-I Facultad de Quimica | UNAM
practica
1
6 CH
2 OH CH 2 OH CH 2 OH CH 2 OH
5 O O O O
H H H H H H H H H H
Nonreducing H H Reducing
4 1 4 1 4 1 4 1
end OH H OH H OH H OH H end
O O O O
3 2
H OH H OH H OH H OH
(a) amylose
6 CH
2 OH
O
H H H
4 1
HIDRÓLISIS DE
OH H
( 1n 6)
O Amylose
branch
Branch H OH point
O
A Reducing
6 CH ends
2
O
CARBOHIDRATOS
H H Nonreducing
H ends
4 1 Amylopectin
OH H
O O
Main H OH
chain
(b) (c)
FIGURE 7–15 Amylose and amylopectin, the polysaccharides of to occur in starch granules. Strands of amylopectin (red) form double-
starch. (a) A short segment of amylose, a linear polymer of D -glucose helical structures with each other or with amylose strands (blue).
residues in ( 1n 4) linkage. A single chain can contain several thou- Glucose residues at the nonreducing ends of the outer branches are
sand glucose residues. Amylopectin has stretches of similarly linked removed enzymatically during the mobilization of starch for energy
residues between branch points. (b) An ( 1n 6) branch point of amy- production. Glycogen has a similar structure but is more highly
lopectin. (c) A cluster of amylose and amylopectin like that believed branched and more compact.
I. INTRODUCCIÓN
Los carbohidratos son derivados polohidroxilicos de aldehídos y cetonas. Debido a sus
diferencias estructurales, sus propiedades varian, siendo por razones estericas y electronicas mas
reactivos los aldehídos que las cetonas.
Las aldosas que son carbohidratos con el grupo funcional aldehido, se oxida fácilmente para dar
ácidos carboxilicos; esto en presencia con algunos reactivos como:
• Reactivo tollens (Ag+ en amoniaco acuoso).
• Reactivo de Fehling(Cu2+ en tartrato de sodio acuoso).
• Reactivo de Benedict(Cu2+ en citrato de sodio acuoso).
En la reaccion que se lleva acabo, la aldosa se oxida y el metal de cada reactivo correspondiente
se reduce. Debido a esto los carbohidratos que se oxidan reciben el nombre de “azucares
reductores”. Estas reaccones se utilizan comunmente para la identificación de azucares
reductores y en la presente practica fue de gran utilidad para corroborar la hidrólisis de un
disacárido y un polisacárido.
Los polisacáridos son carbohidratos que sonstan de 2 unidades de monosacáridos, ls cuales se
liberan al ser sometidas a hidrólisis. El polisacárido es un carbohidrato compuesto por n numero
de unidades de monosacaridos, que se liberan al ser tratadas en una reaccion de hidrólisis.
PRACTICA 1“HIDRÓLISIS DE CARBOHIDRATOS” Semestre 2011 -I
2 PRACTICA 1“HIDRÓLISIS DE CARBOHIDRATOS”
II.OBJETIVOS
• Realizar la hidrólisis e inversión de la sacarosa y comprobar ésta mediante pruebas
químicas y utilizando un polarímetro.
• Hidrolizar almidón, que es un polisacárido, y comprobar su hidrólisis mediante pruebas
químicas.
III. DESARROLLO.
Hidrólisis de la sacarosa (inversión)
Coloque en un tubo de ensaye 3 mL de una disolución de sacarosa al 10 %, agregue 0.5 mL
ácido clorhídrico al 20 % y caliente en baño maría durante 10 minutos. Enfríe la disolución y
neutralice con cuidado y lentamente con NaOH al 2% usando Fenolftaleína como indicador (o
bien puede utilizar papel pH).
Divida la disolución en 2 partes iguales y haga las siguientes pruebas:
-Prueba de Fehling. Mezcle 1 mL de la disolución A* y 1 mL de la disolución B* en un tubo de
ensayo, agregue una parte de la disolución de sacarosa invertida y caliente a ebullición. Haga la
misma prueba para una muestra de la disolución de sacarosa al 10%.
Observe y anote sus resultados.
-Prueba de Benedict. Coloque 1 mL de la disolución de Benedict y agregue 3 gotas de la
disolución de sacarosa invertida, caliente a ebullición y deje enfriar a temperatura ambiente.
Haga la misma prueba para una muestra de la disolución de sacarosa al 10%, observe y anote
sus resultados.
Hidrólisis del almidón
En un matraz Erlenmeyer de 125 mL, coloque 0.3 g de almidón, adicione 25 mL de agua y
caliente a ebullición con flama suave, hasta que el almidón se haya disuelto. Separe 2 mL de
esta disolución y divídalos equitativamente en dos tubos de ensayo para efectuar las pruebas de
Benedict y yodo-yoduro.
Al resto de la disolución de almidón, agregue 3 mL de ácido clorhídrico concentrado y agite,
luego distribuya 12 mL de esta disolución en 12 tubos de ensayo, colocando en cada uno 1 mL,
caliente con flama suave los 12 tubos en un baño María usando un vaso de precipitados de 400
mL que contenga una disolución de salmuera.Cada 5 minutos saque 2 tubos de ensayo, con uno
realice la prueba de Benedict y con el otro haga la prueba de Yodo.
-Prueba de Benedict. A uno de los tubos, agregue 1 gota de fenolftaleína, si es necesario,
neutralice con hidróxido de sodio al 2%; agregue 1 mL de la disolución de Benedict y caliente a
ebullición. Observe el color y anote los resultados. Saque conclusiones al terminar las 6 pruebas.
-Prueba de yodo-yoduro. El otro tubo se enfría y se le agregan 2 gotas de la disolución de yodo-
yoduro, observe el color y anote sus resultados. Saque conclusiones al terminar las 6 pruebas.
Quimica Organica III | Laboratorio
PRACTICA 1“HIDRÓLISIS DE CARBOHIDRATOS” 3
V. RESULTADOS
RESULTADOS DE LAS PRUEBAS REALIZADAS A LA HIDRÓLISIS DE LA SACAROSA (INVERSIÓN).
Prueba de Fehling Prueba de Benedict
Sacarosa Invertida Sacarosa (10%) Sacarosa Invertida Sacarosa (10%)
Prueba positiva, se Prueba positiva,
presento un precipitado Prueba negativa. disolucion cambio de Prueba negativa.
de color naranja. color a naranja.
RESULTADOS DE LAS PRUEBAS REALIZADAS A LA HIDRÓLISIS DE ALMIDÓN.
Tubos con almidón y agua.
Prueba de Benedict Prueba de yodo-yodurado
Prueba positiva, el yodo en presencia de almidon
Prueba negativa con el amidon. forma un complejo con la cadena helicoidal del
polisacárido.
Tubos con almidon y HCl.
Tubo de reaccion y minutos transcurridos
Prueba
Tubo1 Tubo2 Tubo 3 Tubo 4 Tubo 5 Tubo 6
(5 min) (10 min) (15 min) (20 min) (25 min) (30 min)
Prueba Se mantiene
Prueba positiva, se Se ve
el color
Yodo- positiva, el torno a color dismunido el
amarillo. Positivo. Positivo.
yodurado color es muy amarillo tonode
morado. ligeramente Sigue siendo
amarillo.
fuerte. positivo
Benedict Negativo Negativo Negativo Negativo Negativo Negativo
Imágenes complementarias de la hidrólisis de almidón.
Laboratorio | Quimica Organica III
4 PRACTICA 1“HIDRÓLISIS DE CARBOHIDRATOS”
IV. DISCUSION DE RESULTADOS
En el caso de la inversion de la sacarosa, se puede observar como la sacarosa no es un azucar reductor,
puesto que con una prueba de Benedict o Fehling esta no reduce a los iones metalicos presentes en la
disoluciones. Por otro lado la sacarosa invertida (mezcla de D-(+)-Glucosa y D-(-)-Fructosa) si reduce a
a ambas pruebas, dando como resultado un ligero precipitado y cambio de color a naranja en ambos
tubos, esta prueba positiva nos arroja que si se presento una hidrólisis.
El caso de la hidrólisis de almidón se ocuparon 2 tubos testigos que conistian de almidon solvatado en
agua. A uno de ellos se le agrego el reactivo yodo-yoduro y al otro el reativo Benedict, el primero
presento una coloracion morada (positiva en la presencia de almidon) y en el segundo tubo no se
presento el cambio de color o precipitacion, lo cual indica que no existia azucar reductor en disolucion.
Como se observa en la imagen coplementaria de la hidrólisis de almidon en presencia de yodo-yoduro, la
catidad de almidon hidrolisado fue cada vez mayor porque se fue perdiendo la coloracion que da el
complejo almidón-yodo. El caso de las pruebas realizadas con reactivo Benedict no presento precipitado,
pero si un cambio de coloracion, lo que indica que habia azucares reductores solo no en la cantidad
necesaria para provocar una precipitacion.
V. CONCLUSION
Con los resultados arrojados se puede concluir que la hidrólisis de carbohidratos se favorece en
un medio acido. A diferencia de un azucar reductor de uno no reductor se encuentra en la
capacidad de perder un hidrogeno hasta llegar a un acido aldonico.
Las pruebas Benedict y Fehling daran positivos en presencia de un azucar reductor. En el caso
de la hidrólisis de almidón se observa el progreso de reaccion con la decoloracion (desaparicion)
del complejo almidón-yodo.
VI. CUESTIONARIO
1. ¿Por qué el azúcar invertido es más dulce que la sacarosa?
Porque la fructosa es el carbohidrato mas dulce de todos, y al realizar la hidrólisis se deshizo
el enlace que existia entre la D-(+)-glucosa y la D-(-)-Fructosa, dejando libre este azucar, por
lo cual esta mexcla será mas dulce que la sacarosa.
2. Explique por qué se le llama inversión a la hidrólisis de la sacarosa.
Debido a que la rotacion de la luz al pasar a travez de una disolución de sacarosa es de
+65.5º, al realizar la hidrólisis obtenemos una mezcla de D-(+)-glucosa y la D-(-)-Fructosa
las cuales una rota la luz polarizada a la derecha y la otra a la izquierda, teniendo como
resultado una rotacion final de -19.9º, sentido contrario a lo que lo hacia la sacarosa.
3. ¿Por qué no se pueden desechar libremente los afluentes líquidos al drenaje?
Puesto que existen precipitados que podrian ir tapando el desague.
Quimica Organica III | Laboratorio
PRACTICA 1“HIDRÓLISIS DE CARBOHIDRATOS” 5
4. Diga qué tratamiento debería dársele en cada uno para poder desecharlos.
Una recuperacion del Cu2O para poder desechar libremente de esta forma el liquido que los
contenia.
5. En la hidrólisis del almidón qué resultados espera de la prueba de Benedict, sea positiva. De
la prueba yodo-yoduro efectuadas al inicio de la reacción de la hidrólisis se espera sea positiva
pues existe almidon para formar el complejo, y al final de la reacción sea negativa debido a la
escases o falta de la presencia de almidon para la formacionde complejo lo que no daria
coloracion a la disolucion.
6. Defina los siguientes conceptos: actividad óptica, rotación específica y luz polarizada
La rotación óptica o actividad óptica es la rotación de la polarización lineal de la luz cuando
viaja a través de ciertos materiales. Suele ser un fenómeno que ocurre en soluciones que
presentan moléculas quirales tales como la sacarosa (azúcar), sólidos con planos cristalinos
rotados, tales como el cuarzo, y la polarización circular de gases atómicos o moleculares. Se
emplea en la industria de elaboración de azúcar para medir en los siropes la concentración de
azúcares, en óptica para manipular la polarización, en química para caracterizar sustancias
en solución acuosa, y en medicina está siendo evaluado en la actualidad como un método de
determinación de la concentración de azúcar en sangre en casos de personas que sufren la
diabetes.
La rotación específica de un compuesto químico [ ] se define como el ángulo observado de la
rotación óptica cuando el avión- luz polarizada pasa a través de una muestra con una
cubeta de 1 decímetro y una concentración de la muestra de 1 gramo por 1 ml . The specific
rotation of a pure material is an intrinsic property of that material at a given wavelength and
temperature. La rotación específica de un material puro es una propiedad intrínseca de dicho
material en una determinada longitud de onda y la temperatura. Values should always be
accompanied by the temperature at which the measurement was performed and the solvent in
which the material was dissolved. Los valores deben estar siempre acompañados por la
temperatura a la cual la medición se realizó y el disolvente en el que se disolvió el material.
Often the temperature is not specified; in these cases it is assumed to be room temperature. A
menudo, la temperatura no se especifica, en estos casos, se supone que la temperatura
ambiente. The formal unit for specific rotation values is deg dm -1 cm 3 g -1 but scientific
literature uses just degrees . La unidad formal de los valores de rotación específica es dm -1
grados cm 3 g -1, pero la literatura científica sólo utiliza grados . A negative value means
levorotatory rotation and a positive value means dextrorotatory rotation. Un valor negativo
significa levógiro rotación y un valor positivo significa dextrógiro rotación.
La luz natural, la procedente del sol, vibra en cualquier momento en todas las direcciones del
espacio (algo dificil de imaginar), posee pues infinitas direcciones de vibración y su eje
coincide con el rayo. Estas direcciones se pueden representar vibrando dentro de un plano
perpendicular a la dirección de propagación.
La luz polarizada vibra en una sola dirección para cada momento, pero la dirección de
vibración cambia con el tiempo. En la luz polarizada plana (frecuentemente, por simplicidad,
se le llama luz polarizada) la dirección de vibración es única y constante con el tiempo
Laboratorio | Quimica Organica III
6 PRACTICA 1“HIDRÓLISIS DE CARBOHIDRATOS”
VII. BIBLIOGRAFÍA.
• McMurry J. 2008. Química Organica. Cengag Learning. México 7a. Ed. Págs 973-1000.
• ChemDAT: MERCK INDEX DIGITAL CD-ROM, Enso Software, Enero 2006.
• Wade, L.G. Quimica Organica 5ª edicion Pearson Educacion, Madrid España 2004.
Quimica Organica III | Laboratorio
You might also like
- Transcript PDFDocument1 pageTranscript PDFOlee Gerato100% (1)
- Iso 16396 2 2017Document9 pagesIso 16396 2 2017fNo ratings yet
- Dropped Object AnalysisDocument34 pagesDropped Object AnalysisSivaNo ratings yet
- E12 AtqDocument5 pagesE12 AtqCharlene InaoNo ratings yet
- APIChem Featured Products PDFDocument5 pagesAPIChem Featured Products PDFTezozómocNo ratings yet
- GlycogenDocument46 pagesGlycogenjaffar.kl12No ratings yet
- Reducing Sugar Structure PDFDocument7 pagesReducing Sugar Structure PDFKrutikNo ratings yet
- 11 Chapter 2Document20 pages11 Chapter 2NeelutpalGogoiNo ratings yet
- BMB1203 Biochem IIlecture 1Document120 pagesBMB1203 Biochem IIlecture 1Brian Adoka OmdangNo ratings yet
- Mekanisme PDFDocument1 pageMekanisme PDFSoy Viranda KusumaNo ratings yet
- Isomers of Coordination ComplexesDocument12 pagesIsomers of Coordination ComplexesNov IndaNo ratings yet
- Cardiovascular AgentsDocument91 pagesCardiovascular Agentsdagnen27No ratings yet
- Carbohydrates 2Document15 pagesCarbohydrates 2Sanjay ShirodkarNo ratings yet
- No Experiment Tittle/ Subtittle Reagent Used Function of Reagent ReactionDocument9 pagesNo Experiment Tittle/ Subtittle Reagent Used Function of Reagent ReactionLailatul BadriyahNo ratings yet
- Chemistry Common Name.Document1 pageChemistry Common Name.jangidlokeshkumar11No ratings yet
- Chem DrawDocument7 pagesChem DrawPutu Ayu WerdhiantyNo ratings yet
- Structure of MonosacchardiesDocument7 pagesStructure of MonosacchardiesAarthi shreeNo ratings yet
- Kami Export - 6 Biological MoleculesDocument5 pagesKami Export - 6 Biological MoleculesNicholas Crowell100% (1)
- Chemfig: A Tex Package For Drawing MoleculesDocument89 pagesChemfig: A Tex Package For Drawing MoleculesPie LmkNo ratings yet
- (Aqa A Level Science) Teresa Quigg - Aqa A Level Chemistry Studentbook 2 (Aqa A Level Science) - Hodder Education (2015)Document3 pages(Aqa A Level Science) Teresa Quigg - Aqa A Level Chemistry Studentbook 2 (Aqa A Level Science) - Hodder Education (2015)Dr kamruzzaman EyeNo ratings yet
- Chemistry of LifeDocument13 pagesChemistry of LifeAbdulaziz AHNo ratings yet
- HW 10Document2 pagesHW 10pNo ratings yet
- 20 Common Amino Acids Physiological StructuresDocument1 page20 Common Amino Acids Physiological StructuresTewodirosNo ratings yet
- A Guide To The Twenty Common Amino Acids: Chart KeyDocument1 pageA Guide To The Twenty Common Amino Acids: Chart KeyKyu Chang HanNo ratings yet
- Kami Export - Mahdi Mahoozi (Al) - Biological Molecules - StudentDocument5 pagesKami Export - Mahdi Mahoozi (Al) - Biological Molecules - StudentimahdiahmedNo ratings yet
- Glyc o SidesDocument22 pagesGlyc o Sidessiddra khalidNo ratings yet
- BIC 501 - Lec 11 - Biosynthesis of Storage PolysaccharidesDocument29 pagesBIC 501 - Lec 11 - Biosynthesis of Storage Polysaccharides21. JeevaNo ratings yet
- Week 13 WorkshopDocument3 pagesWeek 13 Workshoplayla_loveNo ratings yet
- Chemsheets As 1188 QC Organic Nomenclature B ANSDocument1 pageChemsheets As 1188 QC Organic Nomenclature B ANS19jthorntonNo ratings yet
- Reaksi AlkenaDocument1 pageReaksi Alkenajoel13No ratings yet
- Exam 4 Carbohydrate Sample Problems KeyDocument2 pagesExam 4 Carbohydrate Sample Problems KeyTJ SmithNo ratings yet
- Functionalization of Carbohydrates at C2-6Document22 pagesFunctionalization of Carbohydrates at C2-6Abhinav BhatnagarNo ratings yet
- 去Boc保护Document1 page去Boc保护angle6321No ratings yet
- Kraft Pulping and Recovery Process BasicsDocument50 pagesKraft Pulping and Recovery Process BasicsTri PutriNo ratings yet
- Functional Group Naming TableDocument1 pageFunctional Group Naming Tableinfo.acc231No ratings yet
- Legãturã N-Glicozidicã: O OH OH CH OH O OH OH CH OH H N-RDocument7 pagesLegãturã N-Glicozidicã: O OH OH CH OH O OH OH CH OH H N-Rdeedeeutza14No ratings yet
- Drawing Haworth ProjectionsDocument6 pagesDrawing Haworth ProjectionschoconoodlesNo ratings yet
- Chemie ChemfigDocument88 pagesChemie ChemfigJohn KimNo ratings yet
- SCY1620Document44 pagesSCY1620Shlok WadhonkarNo ratings yet
- Guide To Fruit AcidsDocument1 pageGuide To Fruit AcidsJay McKearnNo ratings yet
- Ejercicios de CiclaciónDocument7 pagesEjercicios de Ciclaciónfrancis160201No ratings yet
- Conjugated Bile Salts Liaflet 2020Document2 pagesConjugated Bile Salts Liaflet 2020Balachandar BNo ratings yet
- Lin Mar 05revisedDocument19 pagesLin Mar 05revisedDoRo DeniTri FcansNo ratings yet
- Experiment 5 Properties of Carbohydrates: Solubility, Reactivity, and Specific RotationDocument9 pagesExperiment 5 Properties of Carbohydrates: Solubility, Reactivity, and Specific RotationCiara marie BernardoNo ratings yet
- 7.014 Handout: Biochemistry I-IIIDocument8 pages7.014 Handout: Biochemistry I-IIIRiriiiNo ratings yet
- The Logic of Chemical Synthesis Corey E J Amp Cheng X M 331 463Document133 pagesThe Logic of Chemical Synthesis Corey E J Amp Cheng X M 331 463bann tvNo ratings yet
- Ejercicios de CiclaciónDocument6 pagesEjercicios de CiclaciónKarla Hdez AcostaNo ratings yet
- FGT-part 2Document38 pagesFGT-part 2Nhung NguyễnNo ratings yet
- Performance Task 3 - Chemical Equations - Diamante Denver-12-MendeleevDocument1 pagePerformance Task 3 - Chemical Equations - Diamante Denver-12-MendeleevJohn Lloyd Langco100% (1)
- Karbohidrat 2Document76 pagesKarbohidrat 2Jagho PraisakaNo ratings yet
- Mike Virnig - Crud PresentationDocument34 pagesMike Virnig - Crud Presentationworquera2507No ratings yet
- What Is Organic Chemistry?Document72 pagesWhat Is Organic Chemistry?gs7514424No ratings yet
- Structure and Function of CarbohydratesDocument27 pagesStructure and Function of CarbohydratesAli SeenaNo ratings yet
- A3 ReactionsDocument3 pagesA3 ReactionshaNo ratings yet
- 9 Glycogen 1Document37 pages9 Glycogen 1micklemagdy50No ratings yet
- Reaksi PembakaranDocument1 pageReaksi PembakaranAhmad FadhliNo ratings yet
- 2022 Edited Chemistry of Carbohydrate 2Document33 pages2022 Edited Chemistry of Carbohydrate 2kel GetanehNo ratings yet
- S22 - URAIAN Dan KONTROL PROSES PEMBUATANDocument7 pagesS22 - URAIAN Dan KONTROL PROSES PEMBUATANTrisnawati AmaliaNo ratings yet
- ChemmyDocument1 pageChemmyM DNo ratings yet
- 1,3 CycloDocument1 page1,3 CycloIsmail ZitouniNo ratings yet
- Lipids 2Document6 pagesLipids 2cumbredinNo ratings yet
- B1.2 ProteinsDocument8 pagesB1.2 Proteinslittleianlau100% (1)
- Capacitors and CapacitanceDocument22 pagesCapacitors and CapacitanceZamantha ZaynnNo ratings yet
- Ay1 - Lecture 20: Dark Matter, Dark Energy, and The Concordance CosmologyDocument28 pagesAy1 - Lecture 20: Dark Matter, Dark Energy, and The Concordance Cosmologyante mitarNo ratings yet
- Acetone KineticsDocument8 pagesAcetone KineticsEddie ChuiNo ratings yet
- 0 044422 Revisionsheetwithak10satDocument11 pages0 044422 Revisionsheetwithak10sathajalisalem4No ratings yet
- VW 60334 enDocument30 pagesVW 60334 enSebastianNo ratings yet
- Ijaest: Adaptation of Watt's Indicator Mechanism in Altitude MeasurementDocument4 pagesIjaest: Adaptation of Watt's Indicator Mechanism in Altitude Measurementhelpdesk9532No ratings yet
- Concrete 5.1 OverviewDocument7 pagesConcrete 5.1 Overviewg7711637No ratings yet
- 1998 - Klimeck - Kleinrahm - Wagner - An Accurate Single-Sinker Densimeter and Measur of PRoT Rel of Argon and Nitrogen in 235 520 K Up To 30 MPaDocument18 pages1998 - Klimeck - Kleinrahm - Wagner - An Accurate Single-Sinker Densimeter and Measur of PRoT Rel of Argon and Nitrogen in 235 520 K Up To 30 MPaAlexanderNo ratings yet
- II Ass Mn5201 Finite Element Applications in ManufacturingDocument2 pagesII Ass Mn5201 Finite Element Applications in ManufacturinggfdczxNo ratings yet
- NEET PPT Chemistry SyllabusDocument14 pagesNEET PPT Chemistry Syllabusshark shashank BendiNo ratings yet
- Bose Einstein StatisticsDocument25 pagesBose Einstein StatisticsmelprvnNo ratings yet
- Laser Cooling at Barc: NewsletterDocument7 pagesLaser Cooling at Barc: NewsletterAshirbadNo ratings yet
- Rutherford ScatteringDocument32 pagesRutherford ScatteringNeena JanNo ratings yet
- Iit MadrasDocument43 pagesIit MadrasPawan BonyNo ratings yet
- Parr Instrument 4592 20151029154753Document30 pagesParr Instrument 4592 20151029154753dharmendraNo ratings yet
- JEE - Momentum L1 - Momentum Conservation - Class 11 - Unacademy JEE - JEE Physics - Namo KaulDocument66 pagesJEE - Momentum L1 - Momentum Conservation - Class 11 - Unacademy JEE - JEE Physics - Namo KaulVidya LakshyaNo ratings yet
- Sans893-2 - LegionellaDocument53 pagesSans893-2 - Legionelladenniskigozi1988No ratings yet
- A266273 PDFDocument54 pagesA266273 PDFfpcaeroinsNo ratings yet
- NEM mps1010 LowDocument5 pagesNEM mps1010 LowarissaNo ratings yet
- Introduction - Definitions - History - Wax Pattern - Spruing - Casting Ring and Liner - Investing - BurnoutDocument140 pagesIntroduction - Definitions - History - Wax Pattern - Spruing - Casting Ring and Liner - Investing - BurnoutAnas KallayilNo ratings yet
- Polyalphaolefin (PAO) Lubricants ExplainedDocument8 pagesPolyalphaolefin (PAO) Lubricants ExplainedHüsam NaylonNo ratings yet
- Grain Boundary Segregation in Oxide Ceramics: P. Wynblatt, G.S. Rohrer, F. PapillonDocument8 pagesGrain Boundary Segregation in Oxide Ceramics: P. Wynblatt, G.S. Rohrer, F. PapilloniprateekNo ratings yet
- Tabla de Propiedades Hfc134a SI PDFDocument26 pagesTabla de Propiedades Hfc134a SI PDFnicolasNo ratings yet
- Material LabDocument5 pagesMaterial LabNELMIDA AIRISH JOY N.No ratings yet
- Lecture 2 Continuous CastingDocument41 pagesLecture 2 Continuous Castingnoahshredx13No ratings yet
- U-Bolt Depot - Round Bend U-BOLTDocument1 pageU-Bolt Depot - Round Bend U-BOLTADJNo ratings yet
- Physics: 2017 Australian Science Olympiad ExamDocument12 pagesPhysics: 2017 Australian Science Olympiad ExamkoNo ratings yet