0 calificaciones0% encontró este documento útil (0 votos)
156 vistasDientamoeba Fragilis
Dientamoeba Fragilis
Cargado por
Jannet Gardenia Figueroa OrralaDientamoeba fragilis es un protozoo flagelado que se localiza en el colon humano y puede causar síntomas como diarrea y dolor abdominal. Tiene distribución mundial aunque su prevalencia varía según factores como la densidad poblacional y los niveles de higiene. Se transmite por vía fecal-oral aunque su mecanismo de transmisión exacto es desconocido. Su diagnóstico requiere la detección directa de sus trofozoítos en heces mediante técnicas de tinción microscópica.
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como DOCX, PDF, TXT o lea en línea desde Scribd
Dientamoeba Fragilis
Dientamoeba Fragilis
Cargado por
Jannet Gardenia Figueroa Orrala0 calificaciones0% encontró este documento útil (0 votos)
156 vistas4 páginasDientamoeba fragilis es un protozoo flagelado que se localiza en el colon humano y puede causar síntomas como diarrea y dolor abdominal. Tiene distribución mundial aunque su prevalencia varía según factores como la densidad poblacional y los niveles de higiene. Se transmite por vía fecal-oral aunque su mecanismo de transmisión exacto es desconocido. Su diagnóstico requiere la detección directa de sus trofozoítos en heces mediante técnicas de tinción microscópica.
Descripción original:
CCQQ
Derechos de autor
© © All Rights Reserved
Formatos disponibles
DOCX, PDF, TXT o lea en línea desde Scribd
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Dientamoeba fragilis es un protozoo flagelado que se localiza en el colon humano y puede causar síntomas como diarrea y dolor abdominal. Tiene distribución mundial aunque su prevalencia varía según factores como la densidad poblacional y los niveles de higiene. Se transmite por vía fecal-oral aunque su mecanismo de transmisión exacto es desconocido. Su diagnóstico requiere la detección directa de sus trofozoítos en heces mediante técnicas de tinción microscópica.
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como DOCX, PDF, TXT o lea en línea desde Scribd
Descargar como docx, pdf o txt
0 calificaciones0% encontró este documento útil (0 votos)
156 vistas4 páginasDientamoeba Fragilis
Dientamoeba Fragilis
Cargado por
Jannet Gardenia Figueroa OrralaDientamoeba fragilis es un protozoo flagelado que se localiza en el colon humano y puede causar síntomas como diarrea y dolor abdominal. Tiene distribución mundial aunque su prevalencia varía según factores como la densidad poblacional y los niveles de higiene. Se transmite por vía fecal-oral aunque su mecanismo de transmisión exacto es desconocido. Su diagnóstico requiere la detección directa de sus trofozoítos en heces mediante técnicas de tinción microscópica.
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como DOCX, PDF, TXT o lea en línea desde Scribd
Descargar como docx, pdf o txt
Está en la página 1de 4
Dientamoeba fragilis
Agente infeccioso: Protozoo. Filo Sarcomastigophora. Flagelado. Pertenece a la misma
familia de protozoos flagelados que incluye Trichomonas, aunque inicialmente, y como
podría sugerir su nombre, se clasificó dentro del grupo de amebas.
Distribución geográfica: Tiene distribución mundial aunque la prevalencia varía según
la distribución geográfica y puede verse influenciada por la densidad poblacional y los
niveles de higiene, puesto que se han encontrado tasas de infección más altas en algunos
grupo como por ejemplo en grupos de personal militar y misioneros.
Ciclo biológico: Localización en el huesped: Colon. Se desconoce el modo de
transmisión de la infección. Se han hecho intentos experimentales para transmitir el
trofozoíto por vía oral, pero no tuvieron éxito. No hay estadío de quiste, y algunos
autores sugieren que el microorganismo se transmite en el interior de los huevos de
oxiuros (E. vermicularis). D. fragilis tiene transmisión fecal-oral, aunque se desconoce
como los trofozoítos pueden sobrevivir fuera del organismo y mantenerse viables tras la
exposición al medio gástrico tras la ingesta. Algunos autores postulan que los
trofozoítos sobreviven dentro de los huevos de helmintos como Enterobius
vermicularis y se transmiten al ingerirse estos últimos. Esto podría explicar la existencia
de coinfecciones con estos dos patógenos, especialmente en niños, pero otros estudios
no han demostrado la correlación entre las infecciones entre D. fragilis y E.
vermicularis.
Periodo de incubación: Desconocido
Clínica: Si bien muchos autores consideran que esta especie no es patógena,
aparentemente puede causar diarrea y molestias abdominales en algunas personas. Se
han identificado al menos dos variantes genéticas pero se desconoce por el momento si
estas exhiben alguna diferencia en cuanto a su patogenicidad.
Se desconoce la proporción de infectados que permanecerán asintomáticos tras la
infección. El parásito se localiza en el colon, donde suele producir colitis y los síntomas
más frecuentes son el dolor abdominal y la diarrea, tanto aguda como recurrente. En
algunos casos se puede detectar eosinofilia periférica, que es un hallazgo excepcional en
las infecciones por protozoos intestinales (La infección por Isospora belli también
puede cursar con eosinofilia en sangre).
Diagnóstico:
Se realiza tras la detección directa de los trofozoítos en heces que se han procesado
correctamente (Fijación y tinción). Los trofozoitos son frágiles y si la muestra no se
procesa adecuadamente conllevará un infradiagnóstico de la infección. También se
utilizan técnicas de cultivo y de PCR, que están disponibles en laboratorios
especializados.
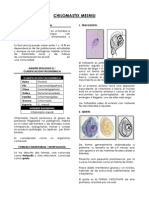
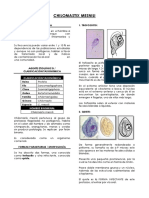
Trofozoíto: Similar al de la ameba, no tiene flagelos evidentes. Los seudópodos son
angulares o lobulados y transparentes. La motilidad no suele ser progresiva. Los
microorganismos miden de 5 a 15 µm (promedio de 9 a 12 µm). Puede haber gran
variación de tamaño en los trofozoítos en la misma muestra de heces. La mayoría
presenta dos núcleos, aunque un 30-40% son uninucleados. Los núcleos no son visibles
en preparaciones sin teñir. Los microorganismos teñidos muestran núcleos con un
cariosoma central formado por cuatro a ocho gránulos. No hay cromatina periférica
sobre la membrana nuclear. El citoplasma puede ser granular fino o grueso y vacuolado;
puede contener bacterias, levadura y otros detritos.
Quistes: Esta especie no tiene estadio de quiste conocido.
Problemas diagnósticos: Los microorganismos se tiñen débilmente y pueden pasar
inadvertidos. Es más difícil identificar a los trofozoítos uninucleados que a los
binucleados porque el núcleo es similar al de E. nana ó E. hartmanni.
PREVALENCIA Dientamoeba fragilis debe ser considerado como un parásito de
distribución cosmopolita. Sin embargo, la prevalencia real no es conocida. Los estudios
actuales provienen de países concretos, y aún dentro de ellos, la variabilidad es muy
importante, con cifras que oscilan entre el 1,5% y el 52%. Estas grandes diferencias
pueden ser debidas al distinto diseño de los estudios, incluyendo las técnicas
diagnósticas aplicadas, pero también la población objeto de estudio, de manera que las
tasas de infección más altas se observan en condiciones de hacinamiento o de higiene
personal deficiente. En algunas ocasiones, D. fragilis resulta ser el enteropatógeno más
frecuente. En nuestro país, la situación no deja de ser sorprendente ya que en los
diferentes estudios coproparasitológicos realizados en los últimos 50 años no existe
referencia alguna de D. fragilis, excepción hecha de Cataluña. Concretamente, un
estudio realizado en 1978- 79 en pacientes que acuden al Servicio de Microbiología del
Hospital de la Santa Creu i Sant Pau y otro estudio realizado en guarderías en 1981-82
detectan frecuencias del 7,8% y del 12,3%, respectivamente, apareciendo D. fragilis
como la segunda especie más prevalente después de Giardia intestinalis. Asimismo, en
el segundo de estos estudios se destaca la mayor incidencia de D. fragilis frente a los
demás protozoos intestinales detectados en aquellos casos con positividad a la
oxiuriasis.
PATOGENIA Dientamoeba fragilis ha sido considerado por diferentes autores como un
organismo meramente comensal, basándose fundamentalmente en la existencia de
portadores asintomáticos y en el hecho de que los síntomas atribuibles a D. fragilis
podrían obedecer a otra etiología. Hoy en día, y aunque existe evidencias
circunstanciales que incriminan a este organismo como patógeno, el debate continua
abierto por la poca información disponible, al no resultar factible el cultivo axénico y
carecer de un modelo adecuado de experimentación animal. En el curso de la infección
por D. fragilis se ha descrito una marcada fibrosis de la mucosa intestinal, así como
diferentes cambios histopatológicos en el apéndice, entre los que se incluye hiperplasia
linfoide, apendicitis catarral, periapendicitis aguda y apendicitis supurada. Aunque no
existen evidencias experimentales que demuestren que D. fragilis es capaz de penetrar
la pared intestinal, bajo ciertas condiciones podría tener este potencial. Se conoce un
caso de colitis ulcerada, al parecer causada por la invasión de la pared intestinal por D.
fragilis, siendo éste el único agente etiológico observado. Resulta relevante el caso de
una niña de cuatro años de edad, sometida a colonoscopia para evaluar un historial de
diarrea crónica con presencia de moco y leucocitos en heces. El colon aparecía
hiperémico y edematoso. Las biopsias identificaron zonas focales con infiltración de
eosinófilos, y una biopsia del colon descendente demostró la presencia de más de 50
eosinófilos por campo. Se aisló D. fragilis y tras el tratamiento, los recuentos de
eosinófilos se resolvieron y la paciente permaneció asintomática durante todo un año
largo de seguimiento. El grado de cambios patológicos inducidos por D. fragilis puede
estar relacionado con el tiempo, la duración y la gravedad de la infección. En cualquier
caso, cabría reseñar que este flagelado intestinal debería formar parte del diagnóstico
diferencial de protozoos patógenos, teniendo en cuenta su capacidad de inducir fibrosis,
ingerir hematíes y producir, bajo ciertas condiciones, lesiones ulcerosas. En esta línea
cabe enmarcar el reciente estudio de los genes ssARNr de 12 aislados de D. fragilis
mediante análisis del polimorfismo del tamaño de los fragmentos de restricción (RFLP).
Los resultados han demostrado la existencia de dos ribodemas, con una divergencia
comparable a la existente entre Entamoeba histolytica y Entamoeba dispar, y aunque
resulta prematuro intentar explicar el diferente potencial patógeno de D. fragilis por la
detección de esta divergencia, ya que se requiere de estudios con un mayor número de
aislados de origen geográficamente diferente, sí al menos evidencia que los organismos
que en la práctica rutinaria de laboratorio están siendo identificados como D. fragilis
representan, como mínimo, dos entidades genéticas significativamente diferentes.
DIAGNÓSTICO El diagnóstico de laboratorio de la dientamoebosis es directo, requiriéndose
heces frescas ,ya que los trofozoítos degeneran a las pocas horas de abandonar el hospedador.
En la observación fecal directa, D. fragilis suele presentar un aspecto redondeado, pasando
inadvertido a menos que el analista sea consciente de la posibilidad de su presencia (Figura 1
A, B). La posterior adición de solución yodada (lugol) confiere el típico color amarillento al
citoplasma pero los núcleos no son teñidos. El excesivo tiempo que puede transcurrir entre el
momento de la toma de la muestra y el procesado de la misma, así como la emisión
intermitente de trofozoítos a lo largo de los días, aconseja la recogida de un mínimo de tres
muestras, obtenidas en días alternos, en frascos conteniendo líquido fijador o conservador. Los
más adecuados son el alcohol polivinílico (APV), el acetato sódico-ácido acéticoformalina (SAF)
y el mertiolato-yodo-formol (MIF). Este último fijador tiene la ventaja de que proporciona
directamente un buen color rosáceo-rojizo a las estructuras parasitarias, si bien en D. fragilis las
estructuras nucleares cuestan de discernir y se requiere de una gran experiencia en la
observación microscópica (Figura 1 C). Tanto el APV como el SAF son compatibles con la
realización de frotis fecales susceptibles de ser teñidos con posterioridad. La elaboración de los
frotis pasa por la absorción previa del exceso de fijador en papel secante y, en el caso del SAF,
además, el portaobjetos debe ser impregnado de una finísima capa de clara de huevo para
asegurar la adherencia de la materia fecal al mismo. De entre las diferentes tinciones de frotis
fecal utilizadas para la detección de D. fragilis, la tricrómica de Gomori modificada o tinción de
Wheatley y la hematoxilina férrica son las más usadas (Figura 1 D, E, F). No obstante, la óptima
combinación de líquido fijador/tinción del frotis resulta de vital importancia. Así, para heces
fijadas con APV, o la variante introducida exenta de mercurio (Para-Pak Zn-PVA), resulta más
recomendable la tinción de Wheatley, mientras que para SAF lo es la hematoxilina férrica. En
cambio, para el líquido fijador de reciente introducción exento de mercurio y formaldehído
(Para-Pak ECOFIX) da mejor resultado la tinción comercializada EcoStain (Meridian
Diagnostic) que la tinción de Wheatley. La observación minuciosa del frotis fecal teñido debe
realizarse con objetivo de inmersión y especial atención debe prestarse a la presencia de
amebas (E. histolytica/E. dispar, Entamoeba hartmanni, Entamoeba coli, Endolimax nana),
formas ameboides de Blastocystis o inclusive leucocitos polimorfonucleares degenerados, ya
que pueden ser motivo de confusión.
También podría gustarte
- Strongiloidosis Corregido PDFDocumento7 páginasStrongiloidosis Corregido PDFYohanly Hernández AlmonteAún no hay calificaciones
- Microbiología Médica I: Patógenos y Microbioma HumanoDe EverandMicrobiología Médica I: Patógenos y Microbioma HumanoCalificación: 5 de 5 estrellas5/5 (1)
- Los Receptores Sensoriales Trabajo de CienciasDocumento13 páginasLos Receptores Sensoriales Trabajo de CienciasLudovina PantojasAún no hay calificaciones
- Cuestionario #6. ListoDocumento13 páginasCuestionario #6. ListoINDIANA MEJIAAún no hay calificaciones
- Dientamoeba FragilisDocumento4 páginasDientamoeba Fragilisclaudiap2802Aún no hay calificaciones
- Parasito G4Documento30 páginasParasito G4Tamara VeraAún no hay calificaciones
- Blastocystis HominisDocumento6 páginasBlastocystis HominisEderRomerLujanCriolloAún no hay calificaciones
- Parasitosis IntestinalesDocumento24 páginasParasitosis IntestinalesFrancisco ChalenAún no hay calificaciones
- AgilisDocumento13 páginasAgilisladyAún no hay calificaciones
- Ciencias de La Salud - Iodamoeba BushliDocumento10 páginasCiencias de La Salud - Iodamoeba BushliJorge RodríguezAún no hay calificaciones
- Diagnóstico de Protozoarios Intestinales Frecuentes en NiñosDocumento12 páginasDiagnóstico de Protozoarios Intestinales Frecuentes en NiñosWilliam Apaza MamaniAún no hay calificaciones
- Diarreas Por Otras Amebas y Absceso Hepático AmebianoDocumento13 páginasDiarreas Por Otras Amebas y Absceso Hepático AmebianoRafael De Souza ReisAún no hay calificaciones
- Entamoeba DisparDocumento19 páginasEntamoeba Disparabreu2021Aún no hay calificaciones
- AMIBIASISDocumento4 páginasAMIBIASISLuisTorrezAún no hay calificaciones
- CryptosporidiumDocumento13 páginasCryptosporidiumByron Giácomo Trigoso MarínAún no hay calificaciones
- E. Nana, I. Butschlii, Dientamoeba FragilisDocumento20 páginasE. Nana, I. Butschlii, Dientamoeba FragilisJanette Zavala ArandaAún no hay calificaciones
- Protozoarios IntestinalesDocumento11 páginasProtozoarios IntestinalesJhoselyn PalominoAún no hay calificaciones
- IsosporiasisDocumento5 páginasIsosporiasisJosé Roberto VidesAún no hay calificaciones
- BlastocistosisDocumento8 páginasBlastocistosisFranco ValderaAún no hay calificaciones
- E1 E.histolyticaDocumento10 páginasE1 E.histolyticaevelynvazarAún no hay calificaciones
- Blastocystis HominisDocumento8 páginasBlastocystis HominisAlex Siles ViayradaAún no hay calificaciones
- Giardiasis: Una Breve Revisión. Perspectivas Diagnósticas en El Laboratorio ClínicoDocumento5 páginasGiardiasis: Una Breve Revisión. Perspectivas Diagnósticas en El Laboratorio ClínicoLuis JuárezAún no hay calificaciones
- AmebiasisDocumento8 páginasAmebiasisReyes KeybisAún no hay calificaciones
- Amebas Angel Landaeta y Diana OsunaDocumento7 páginasAmebas Angel Landaeta y Diana OsunaAngelAún no hay calificaciones
- Parasitología - AmebasDocumento16 páginasParasitología - AmebasEder ReyesAún no hay calificaciones
- Resumen ParasitosDocumento14 páginasResumen ParasitosHerbert LópezAún no hay calificaciones
- Balantidiasis, Giardiasis y TricomoniasisDocumento38 páginasBalantidiasis, Giardiasis y TricomoniasisonlycvnusAún no hay calificaciones
- Amebiasis Intestinal YExtraintestinalDocumento15 páginasAmebiasis Intestinal YExtraintestinalANGIE CAMILA CANDAMIL HENAOAún no hay calificaciones
- A-13 Mondolfi Paublini 2003-04 Amibiasis CMT UCVDocumento19 páginasA-13 Mondolfi Paublini 2003-04 Amibiasis CMT UCVFiorella LoraAún no hay calificaciones
- Universidad Nacional Ecologica Carrera de Bioquimica Y FarmaciaDocumento7 páginasUniversidad Nacional Ecologica Carrera de Bioquimica Y FarmaciaJuan ManuelAún no hay calificaciones
- Blastocystis HominisDocumento9 páginasBlastocystis Hominis05-TL-HU-ALEXANDRA ESPINOZA ARROYOAún no hay calificaciones
- Amebiasis y GiardiasisDocumento16 páginasAmebiasis y GiardiasisJonas Lopez DashingAún no hay calificaciones
- AMEBIASISDocumento7 páginasAMEBIASISRomi Scarlet CanedoAún no hay calificaciones
- ENTAMOEBADocumento3 páginasENTAMOEBAhectormael2022Aún no hay calificaciones
- AmebiasisDocumento6 páginasAmebiasiseduardoAún no hay calificaciones
- Parasitos FlageladosDocumento7 páginasParasitos FlageladosNicole Cumpa OlaecheaAún no hay calificaciones
- Giardia Lamblia (Duodenalis e Intestinalis)Documento7 páginasGiardia Lamblia (Duodenalis e Intestinalis)alejandro45Aún no hay calificaciones
- Traqueobronquitis Infecciosa Canina 2Documento6 páginasTraqueobronquitis Infecciosa Canina 2javiAún no hay calificaciones
- Un Número Importante de Los Parásitos Intestinales Son Seres UnicelularesDocumento3 páginasUn Número Importante de Los Parásitos Intestinales Son Seres UnicelularesJose PopAún no hay calificaciones
- Amebiasis Intestinal YExtraintestinalDocumento18 páginasAmebiasis Intestinal YExtraintestinalCamila MoranAún no hay calificaciones
- AMEBIASISDocumento18 páginasAMEBIASISLucia RojasAún no hay calificaciones
- PROTOZOO Grupo CuatroDocumento25 páginasPROTOZOO Grupo CuatroGUILLERMO MURGA MASAún no hay calificaciones
- Diagnóstico de AmebiasisDocumento8 páginasDiagnóstico de AmebiasisElSimp Arruinado De PanditaAún no hay calificaciones
- Evaluación Jornada de Inducción - Grupo 2Documento4 páginasEvaluación Jornada de Inducción - Grupo 2ana suazoAún no hay calificaciones
- Entamoeba HistolyticaDocumento15 páginasEntamoeba HistolyticaYano MotoharuAún no hay calificaciones
- C. MesniliDocumento2 páginasC. MesniliLis Torres100% (1)
- Entamoeba ColiDocumento5 páginasEntamoeba ColiMarcos Andres Espinoza MendezAún no hay calificaciones
- Resumen de EndolimaxDocumento9 páginasResumen de EndolimaxAnthony Camargo100% (1)
- 2021-2022 CEC Tema 5Documento19 páginas2021-2022 CEC Tema 5María García GonzálezAún no hay calificaciones
- Informe de Practica de ParasitoDocumento10 páginasInforme de Practica de ParasitoWilliam WanderleyAún no hay calificaciones
- Blastocystis SPDocumento8 páginasBlastocystis SPVanessa NolascoAún no hay calificaciones
- Practica 4Documento22 páginasPractica 4ivanAún no hay calificaciones
- C Mesnili PDFDocumento2 páginasC Mesnili PDFSele Maria Carpio100% (1)
- Práctica 32 Giardia, Dientamoeba y BalantioidesDocumento5 páginasPráctica 32 Giardia, Dientamoeba y BalantioidesivanAún no hay calificaciones
- La Amebiasis o AmibiasisDocumento9 páginasLa Amebiasis o AmibiasisDaniel UrbanoAún no hay calificaciones
- Blastocystis HominisDocumento37 páginasBlastocystis HominisWalter Junior Capuñay BravoAún no hay calificaciones
- FLAGELADOSDocumento24 páginasFLAGELADOSErnesto GastelumAún no hay calificaciones
- Prácticas 7-8-9-10Documento6 páginasPrácticas 7-8-9-10VIOLETA NICOLE LINARES PORRASAún no hay calificaciones
- Guia de Parasitologia - 3 - 1 - 20180816214348Documento72 páginasGuia de Parasitologia - 3 - 1 - 20180816214348DJose SCAún no hay calificaciones
- Blastocystis HominisDocumento2 páginasBlastocystis HominisnelsAún no hay calificaciones
- Técnicas para el diagnóstico de endoparásitos de importancia veterinariaDe EverandTécnicas para el diagnóstico de endoparásitos de importancia veterinariaAún no hay calificaciones
- Parásitos. Incidencia y métodos de identificación.De EverandParásitos. Incidencia y métodos de identificación.Calificación: 3 de 5 estrellas3/5 (1)
- Insectos de Interés Médico VeterinarioDocumento15 páginasInsectos de Interés Médico VeterinarioDoris Vanessa Rodriguez ZavaletaAún no hay calificaciones
- Historia de Dos Cachorros de CoatíDocumento16 páginasHistoria de Dos Cachorros de CoatíBelu LhAún no hay calificaciones
- PNL Sexta Parte - Otros 16 ArtículosDocumento75 páginasPNL Sexta Parte - Otros 16 ArtículosDaniel Anti-sofistaAún no hay calificaciones
- Patologia de La RetinaDocumento12 páginasPatologia de La RetinaLuis Enrique C. ChanaAún no hay calificaciones
- Guia de Identificacion de Especies PDFDocumento49 páginasGuia de Identificacion de Especies PDFLiliana CardenasAún no hay calificaciones
- Riesgo Laboral en Vivero Productor de PlantasDocumento280 páginasRiesgo Laboral en Vivero Productor de Plantaslcagnone9649100% (5)
- Proyecion Social - LegislaciónDocumento5 páginasProyecion Social - LegislaciónMARIBEL MARIA PARI FLORESAún no hay calificaciones
- Pollos Valeriana EstrésDocumento11 páginasPollos Valeriana EstrésMiguel Ángel Gil Palma100% (1)
- Actividad de BiologiaDocumento6 páginasActividad de BiologiaYelibeth Florez MonterrozaAún no hay calificaciones
- Ensayo La Historia Mas BellaDocumento6 páginasEnsayo La Historia Mas BellaAlejandra HolguinAún no hay calificaciones
- QUINOLONASDocumento5 páginasQUINOLONASDANIEL CHOQUE MONTESAún no hay calificaciones
- El Arco y El Cesto - Pierre ClastresDocumento2 páginasEl Arco y El Cesto - Pierre ClastresAnabel Gomez50% (2)
- CráneoDocumento5 páginasCráneoSebastián TixiAún no hay calificaciones
- Proyecto de Nectar de Jugo de ManzanaDocumento12 páginasProyecto de Nectar de Jugo de ManzanaAnabel Calixtro Reyes33% (3)
- Los Propósitos de La Botánica Sistemática Una Perspectiva A Través Del Estudio de Las Lauráceas MexicanasDocumento23 páginasLos Propósitos de La Botánica Sistemática Una Perspectiva A Través Del Estudio de Las Lauráceas Mexicanasdaniel mamaniAún no hay calificaciones
- Formato-Informe-final-De Promocion y Prevención de Salud Oral en Escolares.Documento28 páginasFormato-Informe-final-De Promocion y Prevención de Salud Oral en Escolares.Gemita RuizAún no hay calificaciones
- Guacamaya PDFDocumento22 páginasGuacamaya PDFAna Virginia Rodriguez PetterAún no hay calificaciones
- Sociales 3a TallerDocumento5 páginasSociales 3a TallerKatha GarcíaAún no hay calificaciones
- SESION DE APRENDIZAJE Del 29 de NoviDocumento18 páginasSESION DE APRENDIZAJE Del 29 de NoviEsteban TapiaAún no hay calificaciones
- Alteraciones Del Sistema LinfáticoDocumento38 páginasAlteraciones Del Sistema LinfáticoDiana Roxana DorregarayAún no hay calificaciones
- Anexo - Lista Oficial de Especies ForestalesFFFDocumento28 páginasAnexo - Lista Oficial de Especies ForestalesFFFAllinlla Abogados AsociadosAún no hay calificaciones
- Marco TeoricoDocumento3 páginasMarco TeoricoAlissonQuispeAún no hay calificaciones
- Accidentes Por Picadura de Escorpión - Héctor Charry Restrepo.Documento26 páginasAccidentes Por Picadura de Escorpión - Héctor Charry Restrepo.Ophidia.100% (6)
- Primera Jornada de Evaluación General: C U R S O: CienciasDocumento40 páginasPrimera Jornada de Evaluación General: C U R S O: CienciasValentina FigueroaAún no hay calificaciones
- Operatoria: - Detección de Caries DentalDocumento5 páginasOperatoria: - Detección de Caries DentalNeyva GomezAún no hay calificaciones
- Calidad Del Pescado FrescoDocumento198 páginasCalidad Del Pescado FrescoDiana100% (1)
- Biodiversidad de Los Humedales de Villa MariaDocumento8 páginasBiodiversidad de Los Humedales de Villa MariaMarkGutierrezEspinoza100% (1)
- Examen 1 EcologiaDocumento4 páginasExamen 1 EcologiaYuber Fabian Castaño CupitreAún no hay calificaciones