Elektronkonfigurasjon er fordelingen av elektronene i et atom over orbitaler og skall.
Faktaboks
- Uttale
-
elektr'onkonfigurasjon
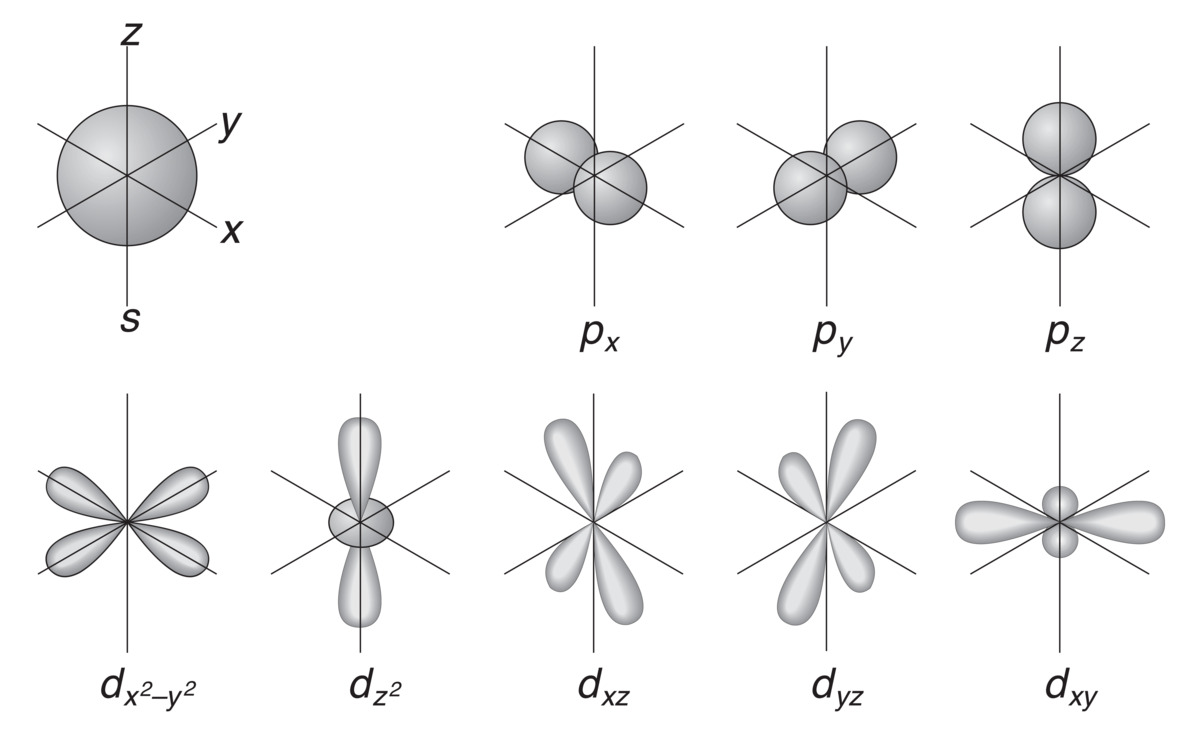
Skisse av atomorbitalenes form. Formen beregnes matematisk ved å løse den kvantefysiske Schrödingerlikningen, og beskriver sannsynligheten for at elektronet befinner seg et gitt sted i atomet. Den sirkulære formen til s-orbitalen uttrykker at alle steder rundt atomkjernen er like sannsynlige med tanke på hvor elektronet befinner seg.
Elektronkonfigurasjon er fordelingen av elektronene i et atom over orbitaler og skall.
elektr'onkonfigurasjon
I stedet for å gå i en bane rundt atomkjernen, er elektronene ifølge kvantefysikken spredt ut som en sky rundt kjernen, med en gitt sannsynlighet for å befinne seg på ulike steder. Dette er et eksempel på en energitilstand som elektroner kan befinne seg i.
Slike energitilstander i atomer karakteriseres ved at de kun kan ha diskrete, bestemte verdier, i stedet for vilkårlige verdier langs et kontinuerlig spekter. Tilstandene karakteriseres ytterligere ved at elektronene har en gitt dreieimpuls i forhold til atomkjernen samt et eget elektronspinn. Hver orbital defineres derfor gjennom et sett av kvantetall som beskriver energien (n), dreieimpulsen (l) og elektronspinnet (s) til elektronene.
En vanlig måte å beskrive atomorbitaler på er å bruke bokstaver i stedet for verdien for dreieimpulsen l. Dette gjøres på følgende måte: orbitaler hvor elektronene har dreieimpuls l=0 kalles for s-orbitaler, l=1 kalles for p-orbitaler mens l=2 kalles for d-orbitaler. Slik fortsetter man å tildele en bokstav for økende dreieimpuls.
Eksempel: en atomorbital 2p beskriver energien til elektronet ved kvantetallet n=2, mens dreieimpulsen til elektronet beskrives ved bokstaven p, som altså tilsvarer l=1. Jo høyere tall, jo mindre bundet er elektronet til atomet.
Antallet elektroner som får plass i en gitt orbital kommer an på verdien til dreieimpulsen l. En oversikt over antall elektroner i orbitalene med lavest energi er som følger:
n=1: l=0 har 2 elektroner
n=2: l=0 har 2 elektroner, l=1 har 6 elektroner
n=3: l=0 har 2 elektroner, l=1 har 6 elektroner, l=2 har 10 elektroner
Grunnstoffet kalium har atomnummer 19. Det vil si at et kaliumatom inneholder 19 elektroner. Det elektronet som har høyest energi i et kaliumatom, er i 4s-orbitalen. De 18 andre elektronene er i fulle skall, slik som elektronkonfigurasjonen i et atom av edelgassen argon.
Et annet eksempel er elektronkonfigurasjonen til gull, som har atomnummer 79 og dermed 79 elektroner i et nøytralt atom.
En fullstendig elektronkonfigurasjon gir skall og orbitaltype til alle elektroner i atomet. For kalium blir dette
1s22s22p63s23p64s1
Den fullstendige elektronkonfigurasjonen til gull blir
1s22s22p63s23p64s23d104p65s24d105p66s14f145d10
som ofte gis i tallrekkefølge
1s22s22p63s23p63d104s24p64d104f145s25p65d106s1
Her er de fire innerste skallene helt fylt opp, femte skall innenfra er delvis fylt opp, og det er et enslig elektron i sjette skall.
Argon har atomnummer 18 og er den edelgassen som står nærmest under kalium i periodesystemet. Elektronkonfigurasjonen for et kaliumatom forkortes derfor ofte til [Ar]4s1. Tilsvarende blir
Elektronkonfigurasjonen for argon er [Ne]3s23p6.
Elektronkonfigurasjonen for neon er [He]2s22p6.
Elektronkonfigurasjonen for helium er 1s2.
I en hakeparentes står først atomsymbolet for det edelgassatomet som står nærmest grunnstoffet og som har et atomnummer som er lavere enn det grunnstoffet man vil skrive opp elektronkonfigurasjonen for. Resten av elektronene fordeles over de ytterste orbitalene som bare er delvis fylt.

Kommentarer
Kommentarer til artikkelen blir synlig for alle. Ikke skriv inn sensitive opplysninger, for eksempel helseopplysninger. Fagansvarlig eller redaktør svarer når de kan. Det kan ta tid før du får svar.
Du må være logget inn for å kommentere.