Elektronparbinding er en sterk kjemisk binding mellom to atomer i et molekyl. Bindingen skyldes deling av et elektronpar mellom de to atomene i molekylet.
Faktaboks
- Også kjent som
-
kovalent binding
Elektronparbinding er en sterk kjemisk binding mellom to atomer i et molekyl. Bindingen skyldes deling av et elektronpar mellom de to atomene i molekylet.
kovalent binding
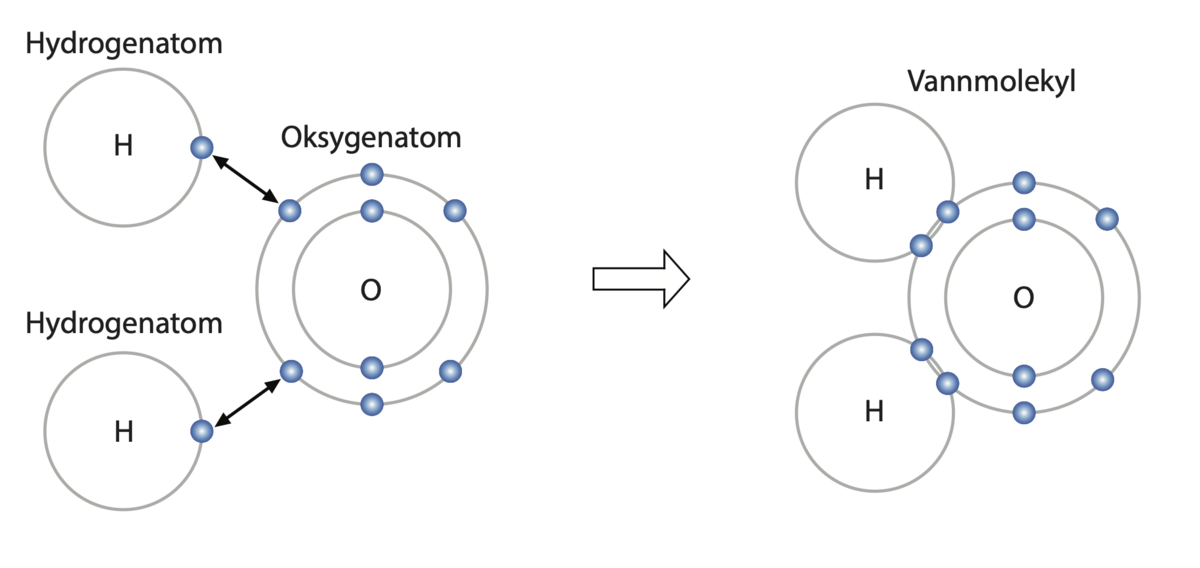
Elektronparbinding mellom to hydrogenatomer og et oksygenatom. Hydrogenmolekylene har ett elektron i det ytterste elektronskallet sitt, mens oksygenmolekylet har seks. Ved å dele på elektronene blir det ytterste elektronskallet i både oksygenatomet og hydrogenatomene fullt.
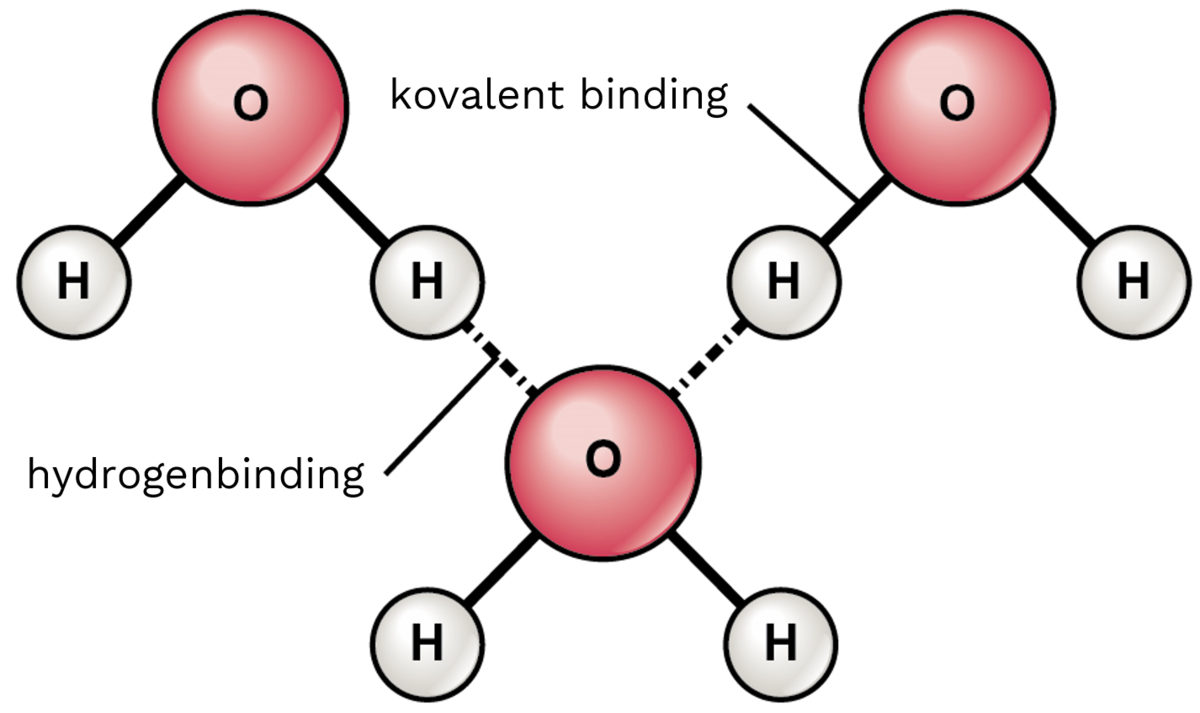
Illustrasjonen viser tre vannmolekyler. Bindingene mellom oksygen og hydrogen i hvert vannmolekyl er elektronparbindinger (også kalt kovalente bindinger). Bindingene mellom et vannmolekyls hydrogenatom og et annets oksygenatom er svake bindinger kalt hydrogenbindinger.
Grunnstoffet hydrogen forekommer vanligvis ikke som enkeltatomer, men som to og to bundet sammen som molekyl: H2. Hvert hydrogenatom har bare ett elektron. Når to hydrogenatomer kommer sammen, kan elektronene danne en elektronparbinding:
H· + H· ⇆ H:H
Prikkene betegner elektroner. En slik binding kan også skrives som H–H, hvor streken betyr et elektronpar.
En mer eksakt beregning av elektronfordelingen i hydrogenmolekylet gir en mindre lokalisert fordeling av elektronene. Denne fordelingen kan heller ses på som en sky av elektroner rundt begge atomkjernene (se kvantekjemi).
I O2-molekylet deler de to atomene to elektronpar O::O, og i N2-molekylet deler de to N-atomene tre elektronpar N:::N.
Deling av ett par kalles en enkeltbinding, deling av to par kalles en dobbeltbinding, og deling av tre elektronpar kalles en trippelbinding.
Tegnet : kan også erstattes med en strek, som i H−H, O=O og N≡N.
Det antas at et atom maksimalt kan være omgitt av fire elektronpar, det vil si åtte elektroner. Denne regelen kalles åtteregelen eller oktettregelen.
Noen grunnstoffer kan bare lage én elektronbinding, andre kan lage flere. Et karbonatom inneholder fire elektroner i det ytterste skallet, et nitrogenatom inneholder fem elektroner, et oksygenatom seks elektroner, et fluoratom sju elektroner og et neonatom åtte elektroner i det ytterste skallet.
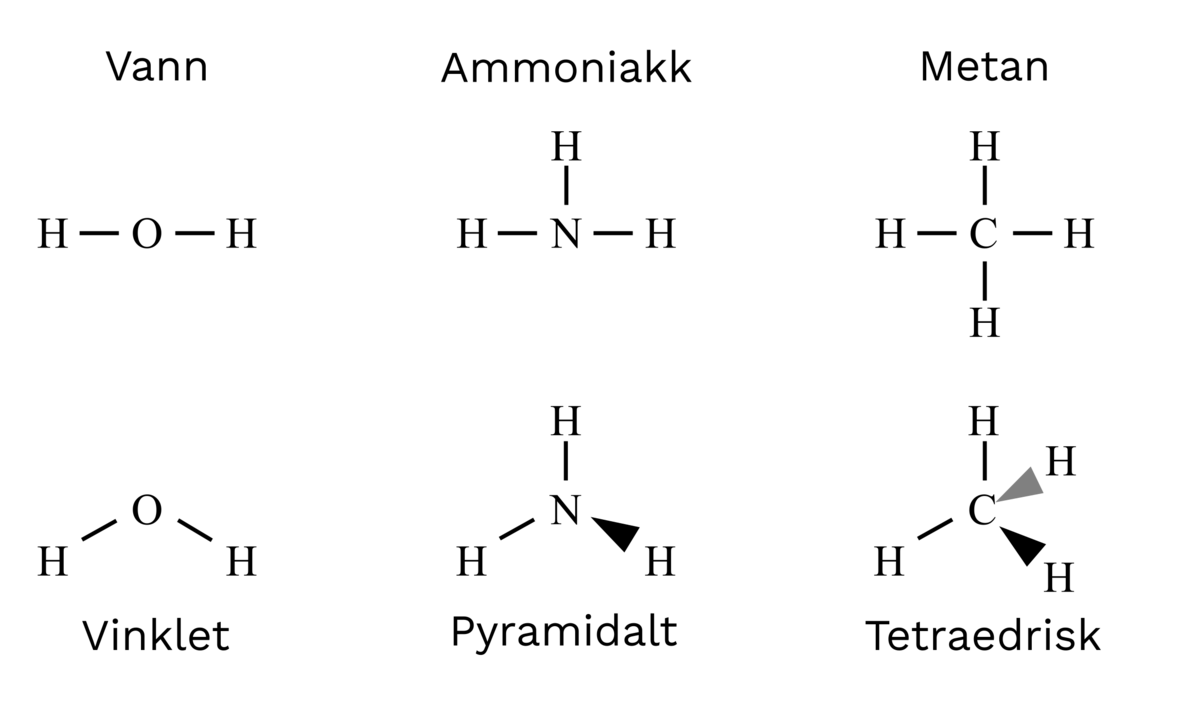
Dersom de fire elektronene i et karbonatom plasseres i hvert sitt par, kan karbonatomet danne elektronparbindinger med fire hydrogenatomer. Et karbonatom bundet til fire hydrogenatomer kalles metan. Strukturformelen for metan er CH4. Tilsvarende blir strukturformelen for ammoniakkmolekylet NH3, for vannmolekylet H2O og for hydrogenfluorimolekylet HF. I disse formlene er ledige elektronpar sløyfet.
Da parene har samme elektriske ladning, frastøter de hverandre og vil være så langt fra hverandre som mulig. Derfor blir metanmolekylet tetraederformet, ammoniakkmolekylet pyramideformet og vannmolekylet vinklet.
Dette passer med hvordan molekylstrukturen er bestemt eksperimentelt.

Kommentarer (2)
skrev Jens L. Nedregård
Hva med "polar" kovalent binding?
svarte Anne Eilertsen
Hei! Vi har en egen artikkel om polar kovalent binding, jeg har nå lagt inn lenke til den herfra. Vennlig hilsen Anne (redaktør)
Kommentarer til artikkelen blir synlig for alle. Ikke skriv inn sensitive opplysninger, for eksempel helseopplysninger. Fagansvarlig eller redaktør svarer når de kan. Det kan ta tid før du får svar.
Du må være logget inn for å kommentere.