SOLUCIÓN DEL EJEMPLO 5.1 Smith
SOLUCIÓN DEL EJEMPLO 5.1 Smith
Cargado por
David RodriguezCopyright:
Formatos disponibles
SOLUCIÓN DEL EJEMPLO 5.1 Smith
SOLUCIÓN DEL EJEMPLO 5.1 Smith
Cargado por
David RodriguezTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Copyright:
Formatos disponibles
SOLUCIÓN DEL EJEMPLO 5.1 Smith
SOLUCIÓN DEL EJEMPLO 5.1 Smith
Cargado por
David RodriguezCopyright:
Formatos disponibles
UNIVERSIDAD NACIONAL DEL CENTRO DEL PERÚ
CÁTEDRA: INGENIERÍA DE LAS REACCIONES QUIMICAS II
ALUMNO: GASPAR DAVIRAN Daniel G.
E.A.P: Ingeniería Química
SOLUCIONARIO DEL EJEMPLO 5.1
En un estudio de la producción de aceites secantes por medio de la descomposición de
aceite de resino acetilado, Grummitt y Fleming correlacionaron los datos de
descomposición en base a una reacción de primer orden representada como
Aceite de ricino acetilado (l) CH,COOH (g) + aceite secante (f)
r = kC
Donde r es la velocidad de descomposición, en gramos de ácido acético producida por
minuto por mililitro, y C es la concentración de ácido acético, en gramos por mililitro,
equivalente al aceite de ricino acetilado. Los datos obtenidos en el intervalo de
temperatura de 295 a 340 “C indicaban una energía de activación de 44 500 cal/mol g, en
concordancia con la siguiente expresión para la constante de velocidad específica de la
reacción, k:
−44500
= + 35.2
Donde T, está en grados Kelvin.
Si un reactor por lotes contiene inicialmente 227 kg de aceite de ricino acetilado a 340 “C
(densidad 0.90) y la operación es adiabática, trace las curvas de conversión (fracción del
aceite acetilado que se descompone) y de temperatura en función del tiempo. Se estima
que el efecto calorífico endotérmico de esta reacción es 62 760 J/mol de vapor de ácido
acético. El aceite acetilado que se carga al reactor contiene 0.156 kg del equivalente de
ácido acético por kg de aceite, esto es, la descomposición total de 1 kg del aceite
produciría 0.156 kg de ácido acético. Suponga que el calor específico de la mezcla
reaccionante líquida es constante e igual a 2.51×l03 J/(kg.K). Suponga también que el
vapor de ácido acético que se forma sale del reactor a la temperatura de la mezcla
reaccionante.
Solución:
Datos:
Base de cálculo: 1kg de aceite acetilado
Ea: 44500 cal/molg
Q: 62760 J/mol
Ce: 2.51×l03 J/(kg.K).
1. Realizando el balance de materia:
= …………(1)
La relación concentración – conversión es:
= (1 − )
Si reemplazamos r con la ecuación de velocidad expresada en términos de la conversión
y la temperatura, la ecuación (1) obtenemos:
=
(60)(1 − )
= ( , )=[ . ]( )
………..(2)
Puesto que el reactor opera adiabáticamente, aplicará la siguiente ecuación. Si tomamos
1 kg de aceite como base, las moles iniciales de ácido acético equivalente son V,C,O =
0.156/60.
.
− =− . ×
( )( − 0)………(3)
= (340 + 273) − 65 ………………….(4)
2. Reemplazando la ecuación (4) en (1) y resolviendo por el método de Rung
Kutta:
*insertando comandos al programa Matlab:
clc, clear all
disp('================================================')
disp('**************MÉTODO DE RUNGE-KUTTA*************')
disp(' INGENIERIA DE LAS REACCIONES QUIMICAS II' )
disp('================================================')
disp('************************************************')
syms x T t
R=1.987;
dTdx=-65+0*x;
dtdx=60/(exp(35.2-44500/(R*T))*(1-x));
x0=0;
xf=0.4;
Ti=340+273;
To(1)=Ti;
ti=0;
n=4;
h=(xf-x0)/n;
i=0;
fprintf(' i x(i) T(i) t(i)\n')
fprintf('************************************************\n')
fprintf(' %2d %10.6f %10.6f %10.6f\n',i,x0,Ti,ti)
while i<n;
x=x0; T=Ti;t=ti;
k1=eval(dTdx); c1=eval(dtdx);
T=Ti+h*k1/2; t=ti+h*c1/2; x=x0+h/2;
k2=eval(dTdx); c2=eval(dtdx);
T=Ti+h*k2/2; t=ti+h*c2/2; x=x0+h/2;
k3=eval(dTdx); c3=eval(dtdx);
T=Ti+h*k3; t=ti+h*c3; x=x0+h;
k4=eval(dTdx); c4=eval(dtdx);
Ti=Ti+h/6*(k1+2*k2+2*k3+k4);
ti=ti+h/6*(c1+2*c2+2*c3+c4);
x0=x0+h;
i=i+1;
xi(i+1)=x0; yi(i+1)=ti; To(1+i)=Ti;
fprintf(' %2d %10.6f %10.6f
%10.6f\n',i,x0,Ti,ti)
end
fprintf('************************************************\n')
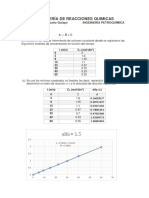
plotyy(yi/60,xi,yi/60,To); title('T° Y CONVERSIÓN EN FUNCIÓN DEL
TIEMPO'),grid on
xlabel('Tiempo, min')
ylabel('Conversión, x')
*Ejecutando el programa
================================================
**************MÉTODO DE RUNGE-KUTTA*************
INGENIERIA DE LAS REACCIONES QUIMICAS II
================================================
************************************************
i x(i) T(i) t(i)
************************************************
0 0.000000 613.000000 0.000000
1 0.100000 606.500000 29.467041
2 0.200000 600.000000 78.439990
3 0.300000 593.500000 161.708750
4 0.400000 587.000000 307.198311
************************************************
T° Y CONVERSIÓN EN FUNCIÓN DEL TIEMPO
0.4 620
0.3 610
Conversión, x
0.2 600
0.1 590
0 580
0 1 2 3 4 5 6
Tiempo, min
También podría gustarte
- Diseño de Reactores 1 (Solucionario)Aún no hay calificacionesDiseño de Reactores 1 (Solucionario)6 páginas
- Tablas Del Vapor de Agua Sistema Internacional100% (1)Tablas Del Vapor de Agua Sistema Internacional14 páginas
- Tarea No. 1 - Diagnostico - Ingenieria de Reactores100% (1)Tarea No. 1 - Diagnostico - Ingenieria de Reactores26 páginas
- Efecto de La Temperatura para El Diseño Óptimo de ReactorAún no hay calificacionesEfecto de La Temperatura para El Diseño Óptimo de Reactor11 páginas
- 2019.03.12 - DISEÑO DE REACTORES I - Cap 3 PDFAún no hay calificaciones2019.03.12 - DISEÑO DE REACTORES I - Cap 3 PDF39 páginas
- Correccion. - Laboratorio Integral 2. - Práctica 14. - Reacción IónicaAún no hay calificacionesCorreccion. - Laboratorio Integral 2. - Práctica 14. - Reacción Iónica17 páginas
- Segundo Examen Parcial de Diseño de Procesos - 2021Aún no hay calificacionesSegundo Examen Parcial de Diseño de Procesos - 20213 páginas
- TAREA No. 3 - Reactores HomogeneosAún no hay calificacionesTAREA No. 3 - Reactores Homogeneos10 páginas
- Resolucion de Ejercicios 7,8,9,10Aún no hay calificacionesResolucion de Ejercicios 7,8,9,107 páginas
- Ejemplo 4 - Proceso de Cavett PDFAún no hay calificacionesEjemplo 4 - Proceso de Cavett PDF2 páginas
- DP-3.1 Construcción de Curvas CompuestasAún no hay calificacionesDP-3.1 Construcción de Curvas Compuestas83 páginas
- INTEGRACIÓN DE MASA - Diseño de ProcesosAún no hay calificacionesINTEGRACIÓN DE MASA - Diseño de Procesos7 páginas
- Seader Cápitulo 1 Procesos de SeparaciónAún no hay calificacionesSeader Cápitulo 1 Procesos de Separación17 páginas
- Trabajo N°1 de Ingenieria de Las Reacciones II-CAMPOS CARDENAS JULIO CESARAún no hay calificacionesTrabajo N°1 de Ingenieria de Las Reacciones II-CAMPOS CARDENAS JULIO CESAR6 páginas
- TAREA 1 Programa Rung Kutta ReaccionesAún no hay calificacionesTAREA 1 Programa Rung Kutta Reacciones4 páginas
- Modelado fenomenológico del proceso de combustión por difusión diéselDe EverandModelado fenomenológico del proceso de combustión por difusión diéselAún no hay calificaciones
- Recirculación de gases de escape mediante sistemas de baja presión en motores diésel sobrealimentadosDe EverandRecirculación de gases de escape mediante sistemas de baja presión en motores diésel sobrealimentados3/5 (3)
- Problemas - Reacciones EnzimaticasAún no hay calificacionesProblemas - Reacciones Enzimaticas2 páginas
- Cuerpo General de Bomberos Voluntarios Del Perú Reglamento Interno de Funcionamiento (SEGÚN DL 1260)Aún no hay calificacionesCuerpo General de Bomberos Voluntarios Del Perú Reglamento Interno de Funcionamiento (SEGÚN DL 1260)127 páginas
- UNMSM Informe Presión de Vapor - Grupo 1AAún no hay calificacionesUNMSM Informe Presión de Vapor - Grupo 1A15 páginas
- Gases Ideales. Leyes de Boyle Charles Gay LussacAún no hay calificacionesGases Ideales. Leyes de Boyle Charles Gay Lussac3 páginas
- Practica: Influencia de La Presión Sobre El Punto de Ebullición.Aún no hay calificacionesPractica: Influencia de La Presión Sobre El Punto de Ebullición.16 páginas
- Ejercicios Solubilidad-Grupo N-22Aún no hay calificacionesEjercicios Solubilidad-Grupo N-2214 páginas
- Evaluación de Biología. 9° - 10.08 - Molaridad, MolalidadAún no hay calificacionesEvaluación de Biología. 9° - 10.08 - Molaridad, Molalidad1 página
- Guía 4 Cs - Experimental Química-Disminución Del Punto de CongelaciónAún no hay calificacionesGuía 4 Cs - Experimental Química-Disminución Del Punto de Congelación8 páginas
- Capitulo 13 Propiedades de Las DisolucionesAún no hay calificacionesCapitulo 13 Propiedades de Las Disoluciones5 páginas
- Problemas de La Ecuacion de Van Der WaalsAún no hay calificacionesProblemas de La Ecuacion de Van Der Waals5 páginas
- CLASE 7a MASA MOLAR, NUMERO DE MOLES Y FORMULAS QUIMICASAún no hay calificacionesCLASE 7a MASA MOLAR, NUMERO DE MOLES Y FORMULAS QUIMICAS31 páginas