Karbonmonoksid er en svært giftig gass uten farge og lukt. Den kalles også kullos. Den kjemiske formelen er CO. For effekten av karbonmonoksid på menneskekroppen, se karbonmonoksid (medisin).
Faktaboks
- Uttale
-
karbonmon(o)åksid
- Også kjent som
-
kullos, CO
Karbonmonoksid dannes når propan, kull, ved og andre karbonholdige materialer brenner uten at det er tilstrekkelig luft til stede. Bruk av gassbrenner i telt eller kjøretøy uten tilstrekkelig lufting har ført til dødsfall. Røyk i branner kan inneholde CO-gass, og derfor være dødelig, men også andre gasser som dannes ved brann kan være giftige.
Eksosgass fra biler inneholder CO. Dette kan føre til forgiftninger i dårlig ventilerte garasjer, eller ved at eksosgassen på annen måte trenger inn i bilen.


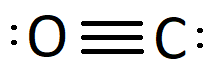



Kommentarer (2)
skrev Kristian Toftenes Askildsen
svarte Bjørn Pedersen
Kommentarer til artikkelen blir synlig for alle. Ikke skriv inn sensitive opplysninger, for eksempel helseopplysninger. Fagansvarlig eller redaktør svarer når de kan. Det kan ta tid før du får svar.
Du må være logget inn for å kommentere.